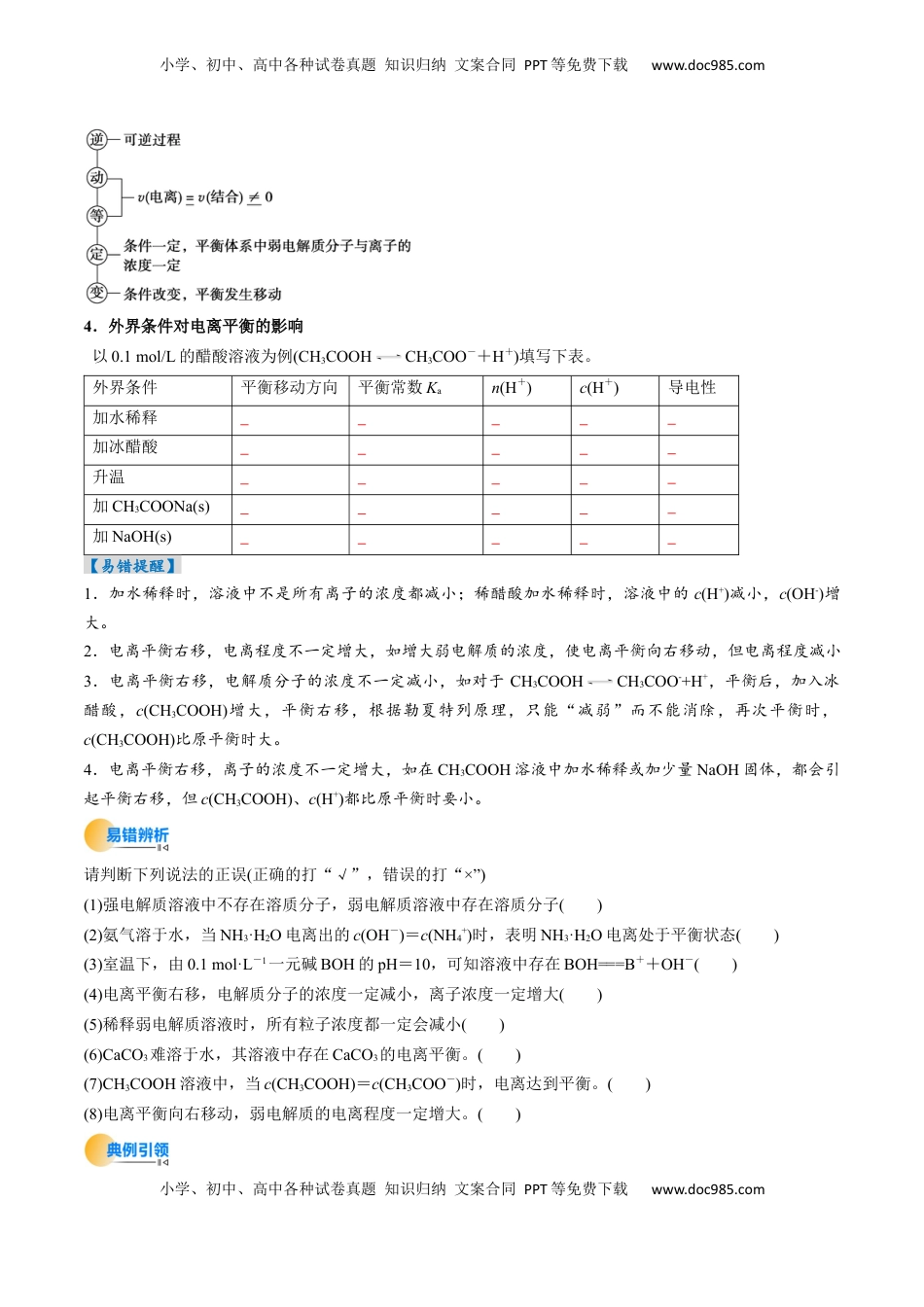
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com考点29电离平衡目录.............................................................................................................................................11.高考真题考点分布...................................................................................................................................12.命题规律及备考策略...............................................................................................................................1.............................................................................................................................................2考法01电离平衡........................................................................................................................................2考法02电离平衡常数................................................................................................................................7...........................................................................................................................................111.高考真题考点分布考点内容考点分布强弱电解质比较2024·湖南卷13题,3分;2024·全国新课标卷7题,3分;2024·河北卷11题,3分;2023湖北卷12题,3分;2022江苏卷12题,3分;2021浙江1月选考17题,2分;2021浙江6月选考19题,2分;电离平衡常数应用2024·江苏卷12题,3分;2023湖北卷14题,3分;2023浙江6月选考15题,3分;2022浙江1月选考17题,2分;2022全国乙卷13题,6分;2022湖北卷15题,3分;2022辽宁卷15题,3分;2021山东卷15题,4分;2.命题规律及备考策略【命题规律】高频考点从近几年全国高考试题来看,强、弱电解质判断、电离方程式、电离平衡常数、微粒浓度大小仍是高考命题的热点。【备考策略】小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【命题预测】预计2025年高考会以新的情境载体考查有关强、弱电解质判断,电离方程式书写和正误判断、微粒浓度大小比较等知识,题目难度一般适中。考法01电离平衡1.强电解质和弱电解质强电解质弱电解质概念在水溶液中能的电解质在水溶液中只能的电解质所含物质类型强酸:HCl、H2SO4、HNO3等强碱:NaOH、KOH、Ca(OH)2等大多数盐:BaSO4、(NH4)2SO4、NaCl等大多数金属氧化物:Na2O、Al2O3等弱酸:H2CO3、CH3COOH、HClO等弱碱:NH3·H2O、Mg(OH)2等水:H2O少数盐:(CH3COO)2Pb等相同点都能电离、都是、都是不同点电离程度,溶质存在形式电离方程式用“=”表示,如:KNO3=K++NO3-用“”表示,如:CH3COOHCH3COO-+H+2.电离平衡在一定条件(如温度、浓度)下,当相等时,电离过程就达到了平衡状态。3.电离平衡的特征小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com4.外界条件对电离平衡的影响以0.1mol/L的醋酸溶液为例(CH3COOHCH3COO-+H+)填写下表。外界条件平衡移动方向平衡常数Kan(H+)c(H+)导电性加水稀释加冰醋酸升温加CH3COONa(s)加NaOH(s)【易错提醒】1.加水稀释时,溶液中不是所有离子的浓度都减小;稀醋酸加水稀释时,溶液中的c(H+)减小,c(OH-)增大。2.电离平衡右移,电离程度不一定增大,如增大弱电解质的浓度,使电离平衡向右移动,但电离程度减小3.电离平衡右移,电解质分子的浓度不一定减小,如对于CH3COOHCH3COO-+H+,平衡后,加入冰醋酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理,只能“减弱”而不能消除,再次平衡时,c(CH3COOH)比原平衡时大。4.电离平衡右移,离子的浓度不一定增大,如在CH3COOH溶液中加水稀释或加少...