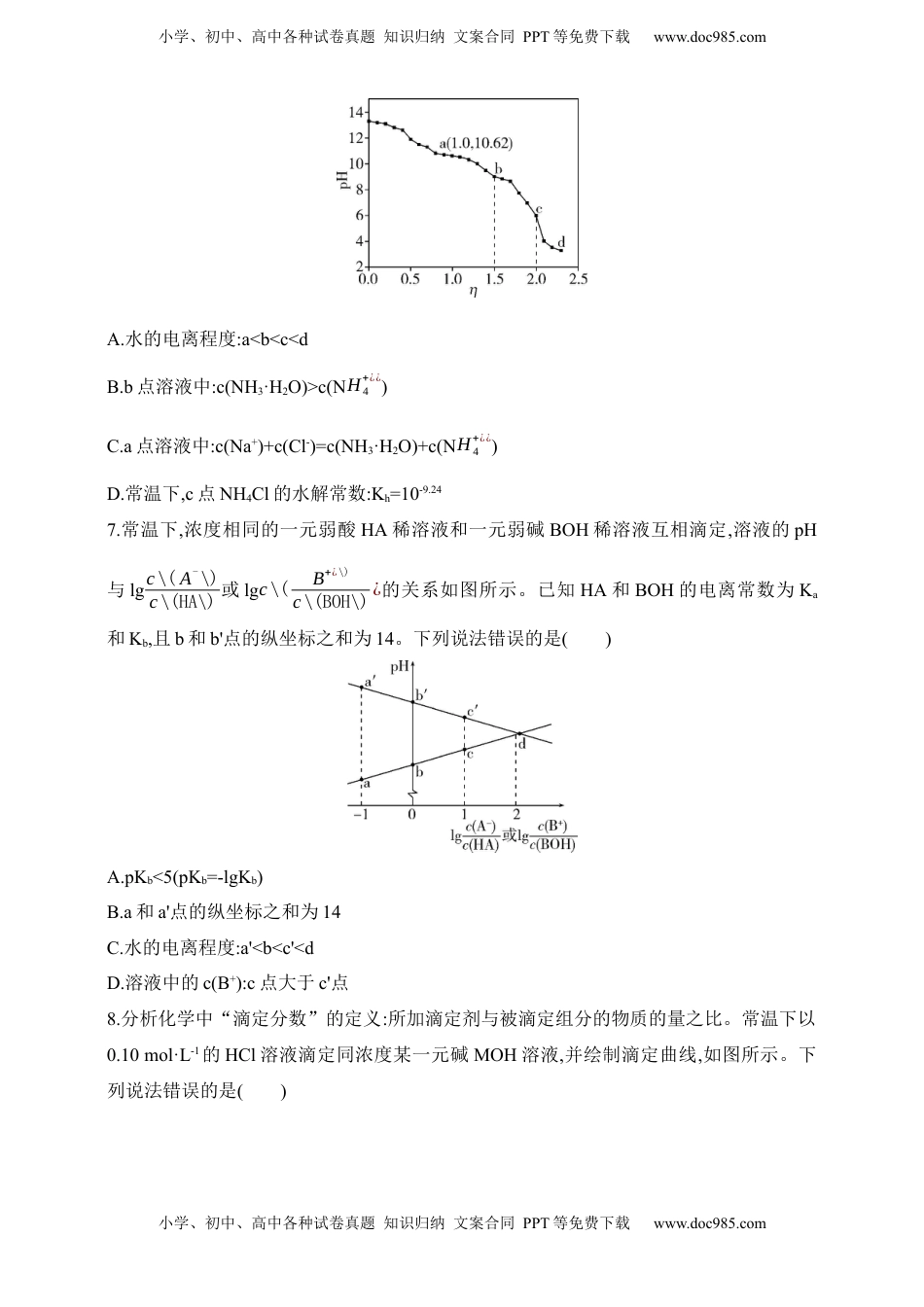
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2025新教材化学高考第一轮十二专题弱解的离平衡和溶液的酸性电质电碱1.NaBiO3是分析化学中的重要试剂,不溶于冷水。实验测定NaBiO3粗产品纯度的步骤如下:①将一定质量的NaBiO3粗产品加入含有足量Mn2+的强酸性溶液中,充分反应后,溶液变为紫红色,同时生成Bi3+;②用一定浓度的草酸(H2C2O4)标准溶液滴定①中反应后的溶液,通过消耗草酸标准溶液的体积计算产品纯度。下列有关说法正确的是()A.步骤①中用硝酸溶液提供强酸性环境B.步骤①中反应的离子方程式为5BiO3-+2Mn2++14H+5Bi3++2MnO4-+7H2OC.步骤②达到滴定终点时紫红色褪去D.步骤②中反应的还原剂和氧化产物的物质的量之比为11∶2.25℃时,两种不同浓度(c1=1.0×10-1mol·L-1、c2=1.0×10-4mol·L-1)的弱酸HB溶液中,lgc(HB)、lgc(B-)、lgc(H+)和lgc(OH-)随pH变化的关系如图所示。Ka为HB的电离常数,电离度α=已电离的溶质分子数原有溶质分子总数×100%,下列说法错误的是()A.d曲线表示c2溶液中B-的变化情况B.当溶液的pH>-lgKa时,c1溶液中满足c(B-)>c(HB)C.P点时c(H+)=c(B-)+c(OH-)D.c1溶液中HB的电离度α=Kac\(H+¿\)+Ka¿×100%(忽略水的电离)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com3.常温下,下列实验方案以及得出的结论均正确的是()A.用广泛pH试纸测NaClO溶液的pH=9,证明HClO为弱酸B.分别测NaHA溶液和NaHB溶液的pH,若NaHA溶液的pH大,则H2A的酸性比H2B弱C.取等体积、等浓度的HA溶液和盐酸,均稀释相同倍数,若稀释后HA溶液的pH较大,则HA为弱酸D.H2A为二元弱酸,其电离平衡常数为Ka1、Ka2,用广泛pH试纸测NaHA溶液的pH,若pH<7,则KW>Ka1·Ka24.室温下,向20mL0.1mol·L-1的HA(Ka=1.0×10-5)溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图中曲线①所示。下列说法错误的是()A.a点pH>5B.水的电离程度:c>b>aC.该滴定实验可选择酚酞作指示剂D.若将HA改为20mL0.1mol·L-1的盐酸,则滴定曲线应如②所示6.常温下,用浓度为0.0200mol·L-1的盐酸标准溶液滴定浓度均为0.0200mol·L-1的NaOH和氨水的混合溶液,滴定过程中溶液的pH随η[η=V\(标准溶液\)V\(待测溶液\)]的变化曲线如图所示。下列说法正确的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.水的电离程度:a<b<c<dB.b点溶液中:c(NH3·H2O)>c(NH4+¿¿)C.a点溶液中:c(Na+)+c(Cl-)=c(NH3·H2O)+c(NH4+¿¿)D.常温下,c点NH4Cl的水解常数:Kh=10-9.247.常温下,浓度相同的一元弱酸HA稀溶液和一元弱碱BOH稀溶液互相滴定,溶液的pH与lgc\(A-\)c\(HA\)或lgc\(B+¿\)c\(BOH\)¿的关系如图所示。已知HA和BOH的电离常数为Ka和Kb,且b和b'点的纵坐标之和为14。下列说法错误的是()A.pKb<5(pKb=-lgKb)B.a和a'点的纵坐标之和为14C.水的电离程度:a'<b<c'<dD.溶液中的c(B+):c点大于c'点8.分析化学中“滴定分数”的定义:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10mol·L-1的HCl溶液滴定同浓度某一元碱MOH溶液,并绘制滴定曲线,如图所示。下列说法错误的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.该酸碱中和滴定过程应该选用甲基橙作指示剂B.x点处的溶液中满足:c(MOH)+c(OH-)<c(M+)+c(H+)C.根据y点坐标可以算得Kb(MOH)=9×10-7D.从x点到z点,溶液中水的电离程度逐渐增大9.25℃时,用0.1mol·L-1NaOH溶液滴定同浓度的H2A溶液,H2A被滴定分数[n\(NaOH\)n\(H2A)]、pH及微粒分布分数δ[δ(X)=c\(X\)c\(H2A)+c\(HA-\)+c\(A2−\),X表示H2A、HA-或A2-]的关系如图所示。下列说法错误的是()A.25℃时,H2A第一步电离平衡常数Ka1≈10-4B.c点溶液中:c(Na+)=2c(HA-)+c(A2-)C.a、b、c、d四点溶液中水的电离程...