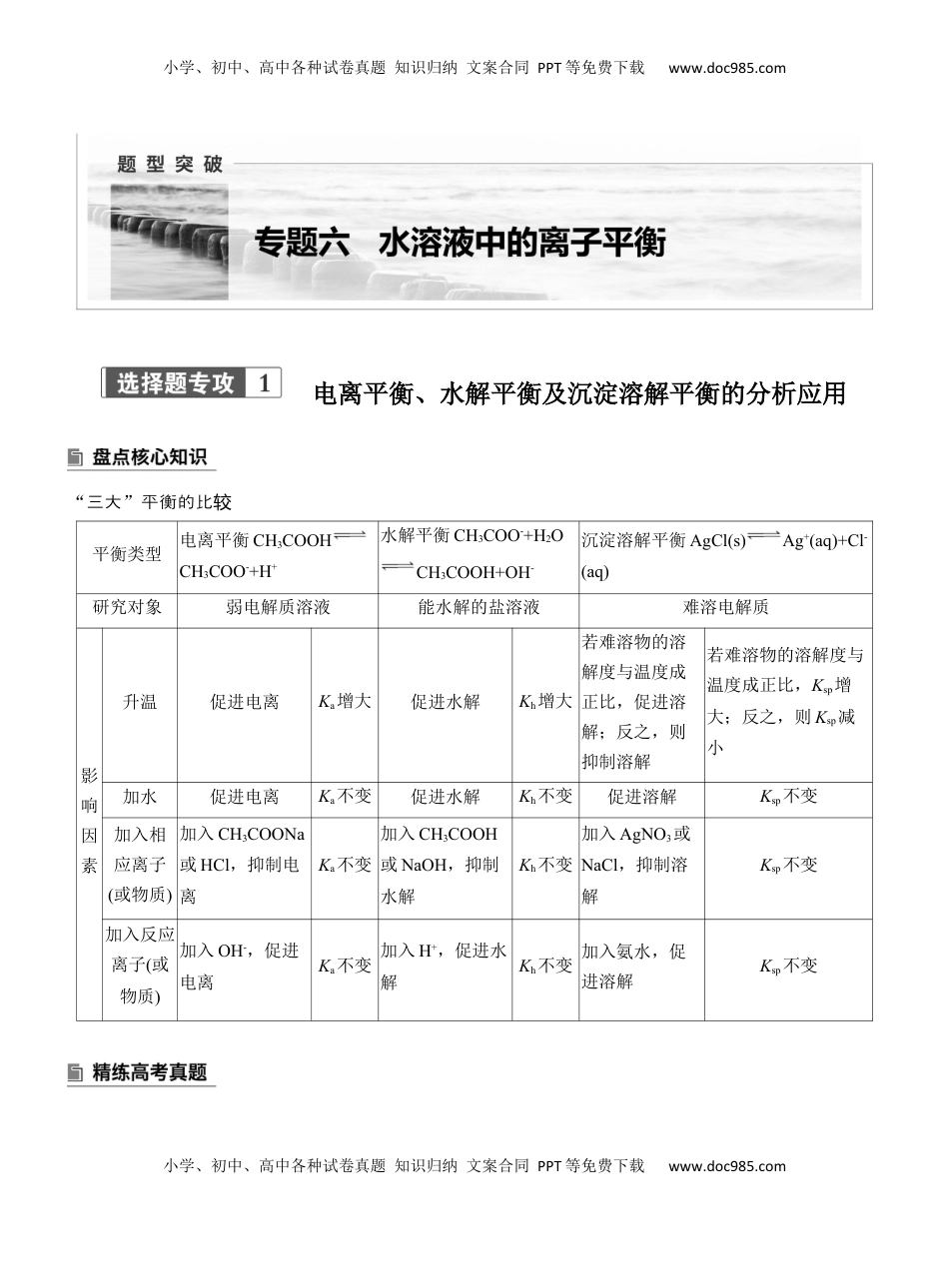
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com电离平衡、水解平衡及沉淀溶解平衡的分析应用“三大”平衡的比较平衡类型电离平衡CH3COOHCH3COO-+H+水解平衡CH3COO-+H2OCH3COOH+OH-沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq)研究对象弱电解质溶液能水解的盐溶液难溶电解质影响因素升温促进电离Ka增大促进水解Kh增大若难溶物的溶解度与温度成正比,促进溶解;反之,则抑制溶解若难溶物的溶解度与温度成正比,Ksp增大;反之,则Ksp减小加水促进电离Ka不变促进水解Kh不变促进溶解Ksp不变加入相应离子(或物质)加入CH3COONa或HCl,抑制电离Ka不变加入CH3COOH或NaOH,抑制水解Kh不变加入AgNO3或NaCl,抑制溶解Ksp不变加入反应离子(或物质)加入OH-,促进电离Ka不变加入H+,促进水解Kh不变加入氨水,促进溶解Ksp不变小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.(2024·州,贵12)硼砂[Na2B4O5(OH)4·8H2O]水溶液常用于pH计的校准。硼砂水解生成等物质的量的B(OH)3(硼酸)和Na[B(OH)4](硼酸钠)。已知:①25℃时,硼酸显酸性的原理B(OH)3+2H2OH3O++Ka=5.8×10-10,②lg❑√5.8≈0.38。下列说法正确的是()A.硼砂稀溶液中c(Na+)=c[B(OH)3]B.硼酸水溶液中的H+主要来自水的电离C.25℃时,0.01mol·L-1硼酸水溶液的pH≈6.38D.等浓度等体积的B(OH)3和Na[B(OH)4]溶液混合后,溶液显酸性2.(2022·全乙卷,国13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是()A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)B.溶液Ⅱ中的HA的电离度[c(A−¿)c总(HA)¿]为1101C.溶液Ⅰ和Ⅱ中的c(HA)不相等D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-43.(2024·浙江1月考,选15)常温下,将等体积、浓度均为0.40mol·L-1BaCl2溶液与新制H2SO3溶液混合,出现白色浑浊;再滴加过量的H2O2溶液,振荡,出现白色沉淀。已知:H2SO3Ka1=1.4×10-2,Ka2=6.0×10-8Ksp(BaSO3)=5.0×10-10,Ksp(BaSO4)=1.1×10-10下列说法不正确的是()A.H2SO3溶液中存在c(H+)>c(HSO3−¿¿)>c(SO32−¿¿)>c(OH-)B.将0.40mol·L-1H2SO3溶液稀释到0.20mol·L-1,c(SO32−¿¿)几乎不变C.BaCl2溶液与H2SO3溶液混合后出现的白色浑浊不含有BaSO3D.存在反应Ba2++H2SO3+H2O2===BaSO4↓+2H++H2O是出现白色沉淀的主要原因小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com答案精析精高考练真题1.B[[Na2B4O5(OH)4·8H2O]水解生成等物的量度的质浓B(OH)3和Na[B(OH)4],B(OH)3的离常电数Ka[B(OH)3]=5.8×10-10,[B(OH)4]-的水解平衡常数Kh([B(OH)4]-)=KwKa=10−145.8×10−10=15.8×10-4>Ka[B(OH)3],[B(OH)4]-水解程度大于B(OH)3离程度,溶液性,电显碱A、D;由错误B(OH)3+2H2OH3O++可知,硼酸水溶液中的H+是由水离出的,电来B正确;25℃,时B(OH)3+2H2OH3O++,Ka=c(H+¿)·c(¿¿¿=5.8×10-10,c(H+)=❑√5.8×10−10×c[B(OH)3]=❑√5.8×10−12mol·L-1=❑√5.8×10-6mol·L-1,pH≈6-0.38≈5.62,C。错误]2.B[常下,溶液温Ⅰ的pH=7.0,溶液则Ⅰ中c(H+)=c(OH-)=1×10-7mol·L-1,c(H+)<c(OH-)+c(A-),A;错误常下,溶液温Ⅱ的pH=1.0,溶液中c(H+)=0.1mol·L-1,Ka(HA)=c(H+¿)·c(A−¿)c(HA)¿¿=1.0×10-3,c总(HA)=c(HA)+c(A-),则0.1c(A−¿)c总(HA)−c(A−¿)¿¿=1.0×10-3,解得c(A−¿)c总(HA)¿=1101,B正确;根据意,未离的题电HA可自由穿隔膜,故溶液过Ⅰ和Ⅱ中的c(HA)相等,C;常下,溶液错误温Ⅰ的pH=7.0,溶液Ⅰ中c(H+)=1×10-7mol·L-1,Ka(HA)=c(H+¿)·c(A−¿)c(HA)¿¿=1.0×10-3,c总(HA)=c(HA)+c(A-),10−7[c总(HA)−c(HA)]c(HA)=1.0×10-3,溶液Ⅰ中c总(HA)=(104+1)c(HA);溶液Ⅱ中,由B解析可知项c总(HA)=1.01c(HA),未离...