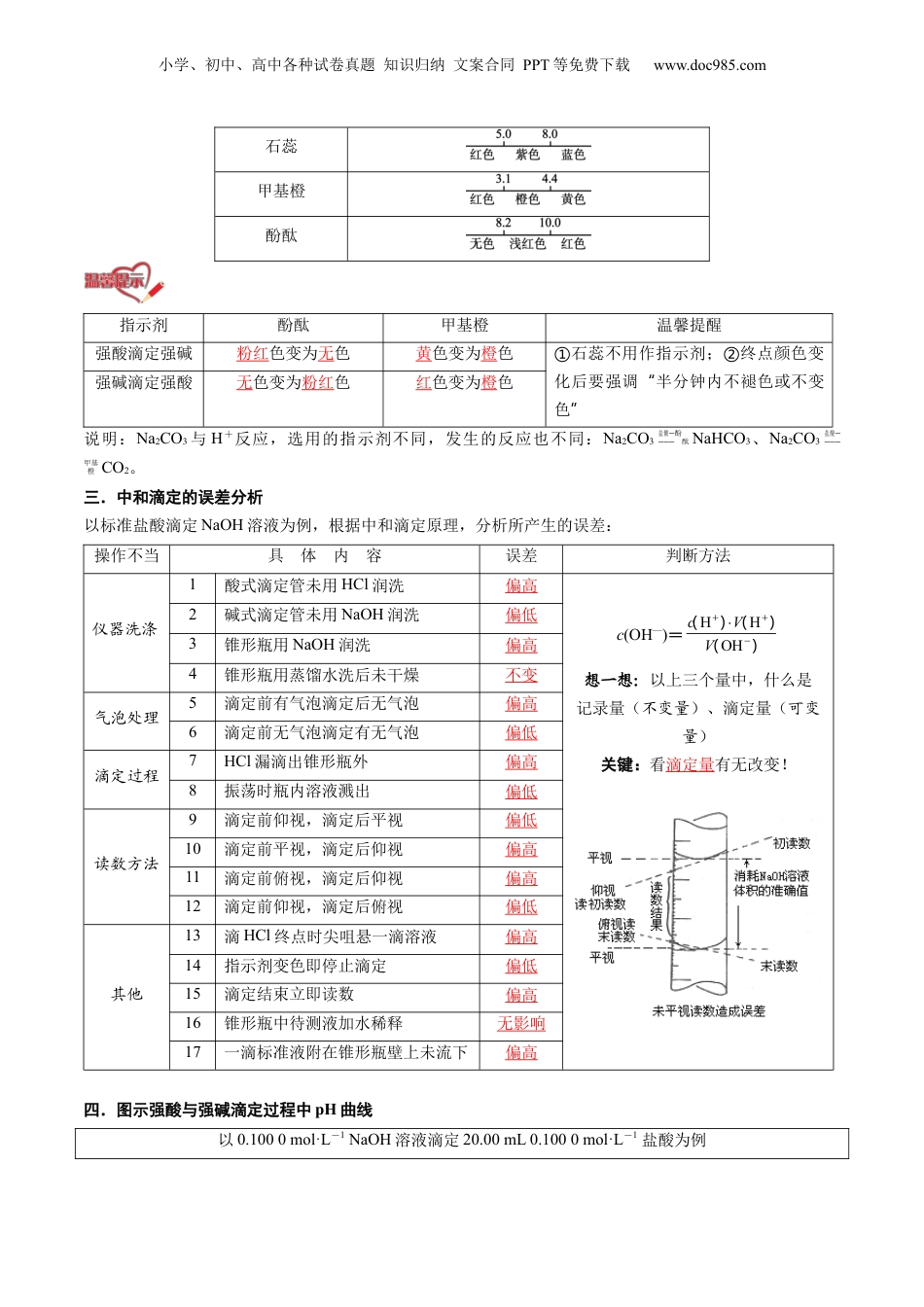
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第10讲酸碱中和滴定及其应用模块一思维导图串知识模块二基础知识全梳理模块三重点难点必掌握模块四核心考点精准练模块五小试牛刀过关测1.知道滴定管的构造、用途以及使用方法。2.学会指示剂的选择并能判断滴定终点,能判断滴定过程中所产生的实验误差。3.能通过酸碱中和滴定的方法测定酸或碱的浓度,掌握数据分析与处理的方法,培养定量研究的意识。一.酸碱中和滴定概念依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法原理以HCl溶液为标准液,滴定待测液NaOH溶液为例:在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等,即c(测)=关键准确测定待测液①NaOH溶液的体积。选择合适的指示剂,准确判断滴定的终点。②小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com滴定操作主要仪器酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶、大烧杯精确度是百分之一。即①可精确到0.01mL!读数时,视线、刻度、②液面的凹面最低点在同一水平线上。③滴定管洗净后必须待装液润洗,而锥形瓶则不能用待盛液润洗试剂待测液①(NaOH溶液);标准液②(标准液HCl溶液);指示剂③(一般用酚酞或甲基橙,一般不用石蕊,颜色改变不明显)滴定前准备锥形瓶:洗涤装待测液记体积加指示剂→→→滴定终点判断滴入最后一滴HCl溶液时,溶液由黄色变成橙色,且半分钟内不恢复原来的颜色停止滴定,并记录HCl溶液的体积,重复上述操作2~3次数据处理为减少实验误差,重复实验2~3次,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。如:求出消耗HCl溶液的平均值(若三次滴定分分别消耗盐酸的体积为20.02mL、19.98mL、23.00mL,则23.00mL与其他数据相差较大,要舍去),根据原理进行计算滴定终点判断当滴入最后半滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。解答此类题目注意三个关键点:最后半滴:必须说明是滴入最后半滴溶液。①“”颜色变化:必须说明滴入最后半滴溶液后溶液颜色的变化。②“”“”半分钟:必须说明溶液颜色变化后半分钟内不再恢复原来的颜色。③“”二.常见酸碱指示剂及变色范围指示剂变色范围和pH小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com石蕊甲基橙酚酞指示剂酚酞甲基橙温馨提醒强酸滴定强碱粉红色变为无色黄色变为橙色石蕊不用作指示剂;终点颜色变①②化后要强调半分钟内不褪色或不变“色”强碱滴定强酸无色变为粉红色红色变为橙色说明:Na2CO3与H+反应,选用的指示剂不同,发生的反应也不同:Na2CO3盐酸————酚酞NaHCO3、Na2CO3盐酸————甲基橙CO2。三.中和滴定的误差分析以标准盐酸滴定NaOH溶液为例,根据中和滴定原理,分析所产生的误差:操作不当具体内容误差判断方法仪器洗涤1酸式滴定管未用HCl润洗偏高c(OH—)=)()()(OHHHVVc想一想:以上三个量中,什么是记录量(不变量)、滴定量(可变量)关键:看滴定量有无改变!2碱式滴定管未用NaOH润洗偏低3锥形瓶用NaOH润洗偏高4锥形瓶用蒸馏水洗后未干燥不变气泡处理5滴定前有气泡滴定后无气泡偏高6滴定前无气泡滴定有无气泡偏低滴定过程7HCl漏滴出锥形瓶外偏高8振荡时瓶内溶液溅出偏低读数方法9滴定前仰视,滴定后平视偏低10滴定前平视,滴定后仰视偏高11滴定前俯视,滴定后仰视偏高12滴定前仰视,滴定后俯视偏低其他13滴HCl终点时尖咀悬一滴溶液偏高14指示剂变色即停止滴定偏低15滴定结束立即读数偏高16锥形瓶中待测液加水稀释无影响17一滴标准液附在锥形瓶壁上未流下偏高四.图示强酸与强碱滴定过程中pH曲线以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1盐酸为例小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽...