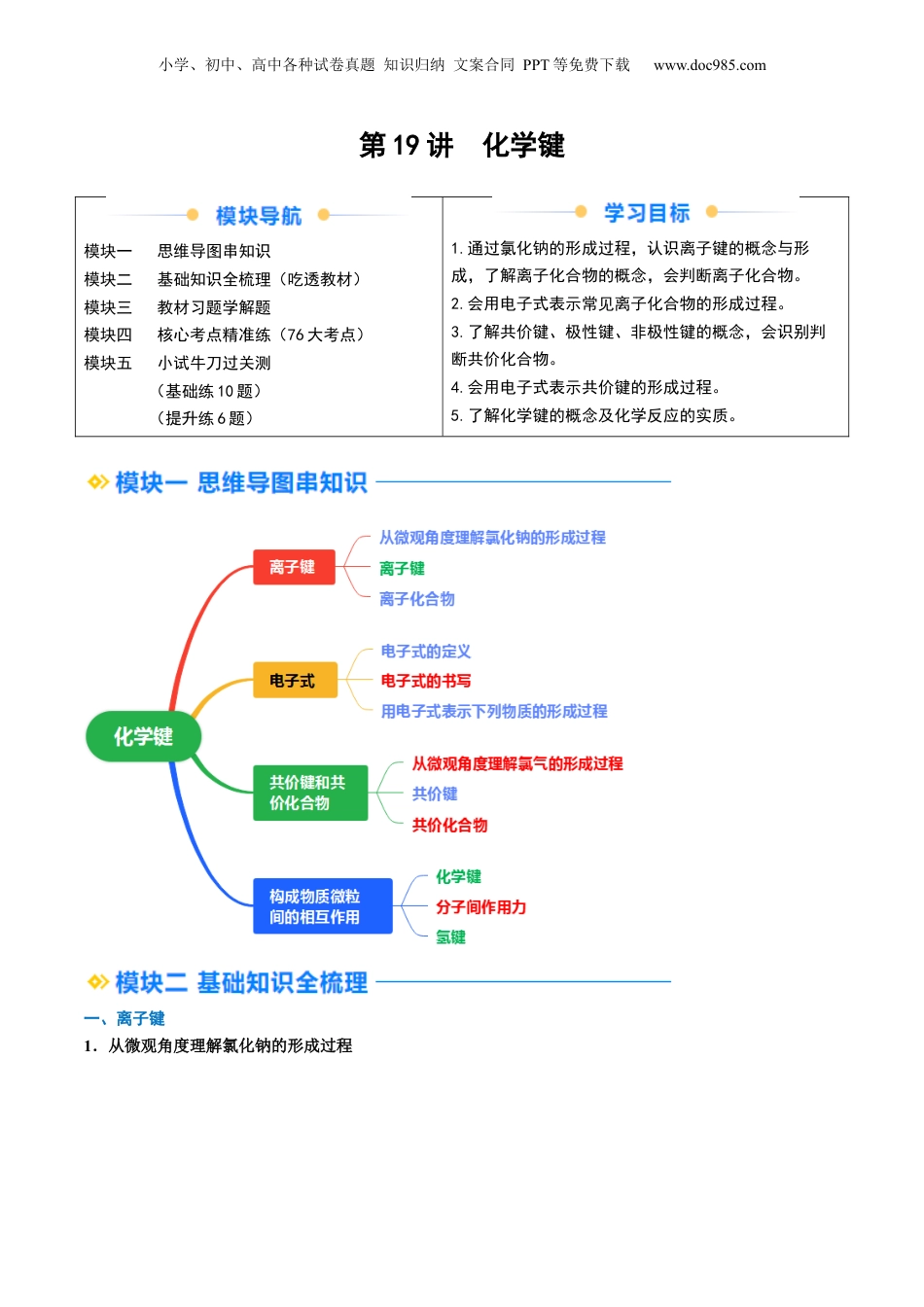
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第19讲化学键模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(76大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.通过氯化钠的形成过程,认识离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。2.会用电子式表示常见离子化合物的形成过程。3.了解共价键、极性键、非极性键的概念,会识别判断共价化合物。4.会用电子式表示共价键的形成过程。5.了解化学键的概念及化学反应的实质。一、离子键1.从微观角度理解氯化钠的形成过程小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com不稳定的钠原子和氯原子通过得失电子后最外层都达到稳定结构,分别形成Na+和Cl-,带相反电荷的Na+和Cl-通过结合在一起,形成新物质氯化钠。2.离子键3.离子化合物【特别提醒】(1)活泼金属元素[如第ⅠA族(Na、K),第ⅡA族(Ca、Mg)]与活泼非金属元素[如第ⅥA族(O、S),第ⅦA族(F、Cl)]之间易形成离子键。(2)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。(3)非金属元素也可形成离子键,如NH4Cl中,NH与Cl-间的化学键就是离子键。(4)离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。二、电子式1.定义在元素符号周围用“·”或“×”来表示原子的的式子叫做电子式。2.书写(1)原子的电子式元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。例如:镁原子:;碳原子:;氧原子:;氖原子:。(2)简单阳离子的电子式小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,例如:Na+、Li+、Mg2+、Al3+等。(3)简单阴离子的电子式不但要画出最外层电子数,而且还应用“[]”括起来,并在右上角标出“n-以表示其所带的电荷。例”如:氯离子:、硫离子:。(4)离子化合物的电子式氧化钙:、硫化钾:。提示相同离子不合并,分列在另一离子的周围。3.用电子式表示下列物质的形成过程(1)NaCl:。(2)MgBr2:。【归纳总结】书写电子式的注意事项(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即原子的最外层电子数。(2)同一原子的电子式不能既用“×”又用“·”表示。(3)“[]”在所有的阴离子、复杂的阳离子中出现。(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaF2要写成,不能写成,也不能写成。(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“―前是原子的电子式→”,“―后是化合物的电子式。→”三、共价键和共价化合物1.从微观角度理解氯气的形成过程→→→请你根据上述图示,用电子式表示其形成过程:。2.共价键(1)概念:原子间通过所形成的相互作用。(2)成键三要素成键微粒:①。成键元素:一般是同种的或不同种的②元素。成键条件:成键前原子最外层电子未达到饱和状态。③(3)分类小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com3.共价化合物四、共价分子结构的表示方法1.常见单质的电子式与结构式在化学上,常用一根短线表示“—”1对共用电子的图示叫做结构式。分子H2N2Cl2电子式结构式2.常见化合物的电子式、结构式和空间结构分子H2OCO2CH4电子式结构式O==C==O空间结构五、构成物质微粒间的相互作用1.化学键2.分子间作用力小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)分子间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称。(2)由分子构成的物质,其熔、沸点等物理性质主要由大小决定。3.氢键(1)氢键不是化学键,通常把氢键看作是一种特殊的分子间作用力。氢键比化学键,比范德华力。(2)分子间形成的氢键会使物质的熔点和沸点,水分子间的氢键可使其密度在固态时液态时的密度...