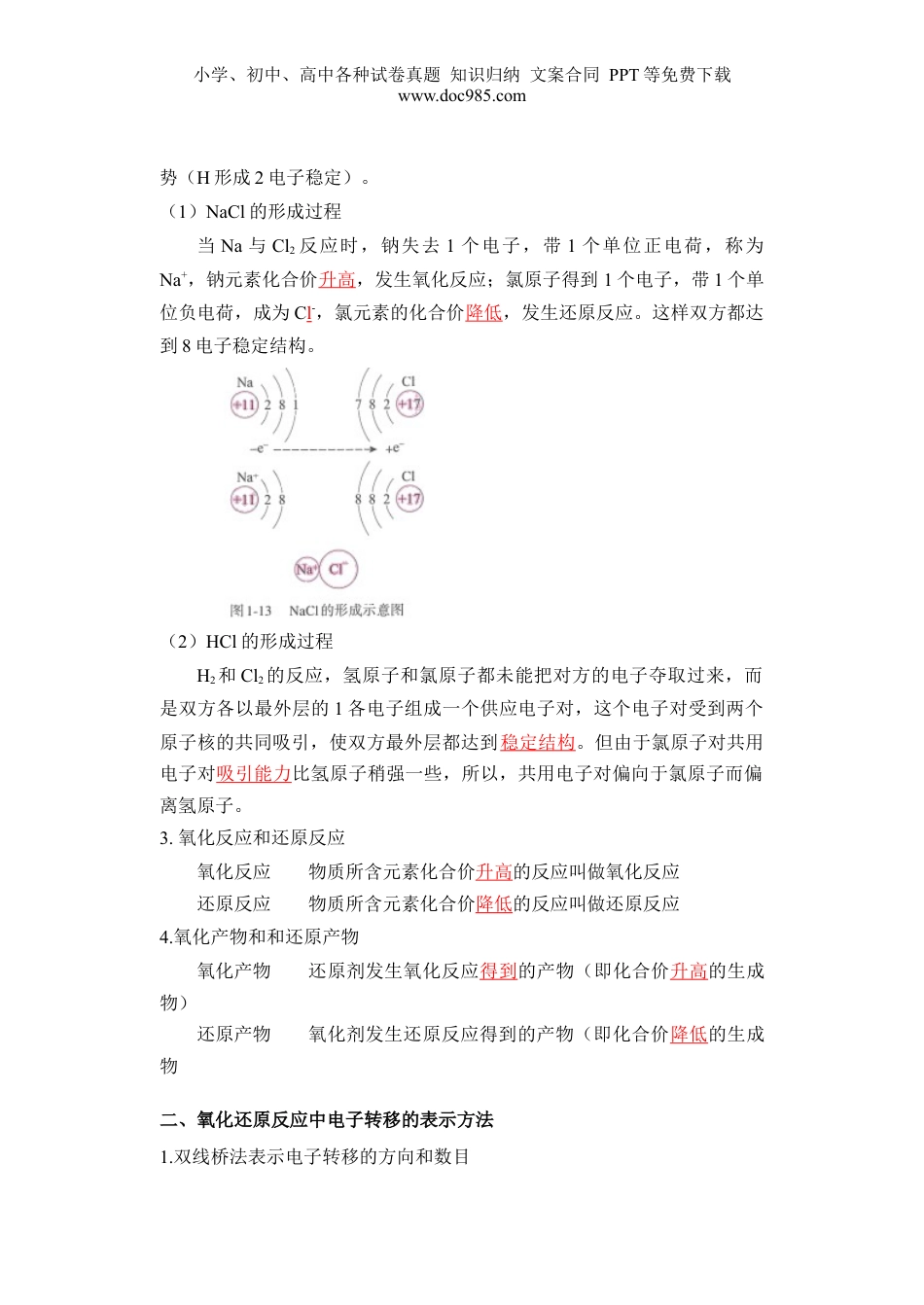
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第03讲氧化还原反应的基本概念1.认识有化合价变化的反应是氧化还原反应,知道氧化反应、还原反应,氧化剂及还原剂的概念。2.能从电子得失或电子对偏移的角度理解氧化还原反应的本质,学会用双线桥及单线桥表示电子转移的方向和数目。3.能利用氧化还原反应概念对常见的反应进行分类和分析说明。一、氧化还原反应基本概念1.特征和概念(1)特征:元素的化合价在反应前后发生了变化。物质所含元素化合价升高为氧化反应,物质所含元素化合价降低为还原反应,氧化反应和还原反应发生在同一反应中。(2)概念:凡是有元素化合价升降的化学反应称之为氧化还原反应例:2CuO+C=====2Cu+CO2↑Fe+CuSO4=====Cu+FeSO42Na+Cl2=====2NaCl【归纳总结】①氧化还原反应有元素化合价变化,但并不是所有元素化合价均发生变化。②化合价升降可以发生在不同元素间,也可以发生在同种元素间。③根据反应前后元素的化合价有无变化,判断反应是否为氧化还原反应。④有单质参加或生成的反应不一定是氧化还原反应,如同素异形体间的相互转化。2.本质:存在电子的转移(电子的得失或电子对的偏移)从原子结构来看,在化学反应中,元素原子都有达到8电子稳定结构的趋小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com势(H形成2电子稳定)。(1)NaCl的形成过程当Na与Cl2反应时,钠失去1个电子,带1个单位正电荷,称为Na+,钠元素化合价升高,发生氧化反应;氯原子得到1个电子,带1个单位负电荷,成为Cl-,氯元素的化合价降低,发生还原反应。这样双方都达到8电子稳定结构。(2)HCl的形成过程H2和Cl2的反应,氢原子和氯原子都未能把对方的电子夺取过来,而是双方各以最外层的1各电子组成一个供应电子对,这个电子对受到两个原子核的共同吸引,使双方最外层都达到稳定结构。但由于氯原子对共用电子对吸引能力比氢原子稍强一些,所以,共用电子对偏向于氯原子而偏离氢原子。3.氧化反应和还原反应氧化反应物质所含元素化合价升高的反应叫做氧化反应还原反应物质所含元素化合价降低的反应叫做还原反应4.氧化产物和和还原产物氧化产物还原剂发生氧化反应得到的产物(即化合价升高的生成物)还原产物氧化剂发生还原反应得到的产物(即化合价降低的生成物二、氧化还原反应中电子转移的表示方法1.双线桥法表示电子转移的方向和数目小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com注意:a.“e-”表示电子。b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素,应标出“得”与“失”及得失电子的总数。c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂d.被氧化得到的产物是氧化产物,被还原得到的产物是还原产物2.单线桥法(从失→得)【说明】单线桥和双线桥两种表示方法的形式不同,实质相同。在分析氧化还原反应中电子转移、化合价升降、物质被氧化、被还原等关系时,用“双线桥”方便;在表示电子转移的方向和数目时用“单线桥”方便。三、氧化还原反应中的七组关系氧化还原反应实质是电子的转移,因此元素的化合价必然有升有降,我们把化合价能升高的元素或含该元素的物质称还原剂;反之称为氧化剂。按照矛盾论的观点,在氧化还原反应中存在如下七对矛盾:(1)还原剂与氧化剂;(2)还原性具有还原性与氧化性具有氧化性;(3)还原剂失电子与氧化剂得电子;(4)还原剂中元素化合价升高与氧化剂中元素化合价降低;(5)还原剂发生氧化反应与氧化剂发生还原反应;小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(6)还原剂被氧化与氧化剂被还原;(7)氧化反应生成氧化产物与还原反应生成还原产物。这七对矛盾在所有的氧化还反应中都是存在的。七对矛盾又可以用两条线贯穿它们之间的联系:还原剂—具有还原性--失电子—元素化合价升高—发生氧化反应--被氧化—生成氧化产物;氧化剂—具有氧化性--得电子—元素化合价降低—发生还原反应—被还原—生成还原产物。典型的氧化还原反应可以简单表示为:氧化剂+还原剂=氧化产物+还原产物...