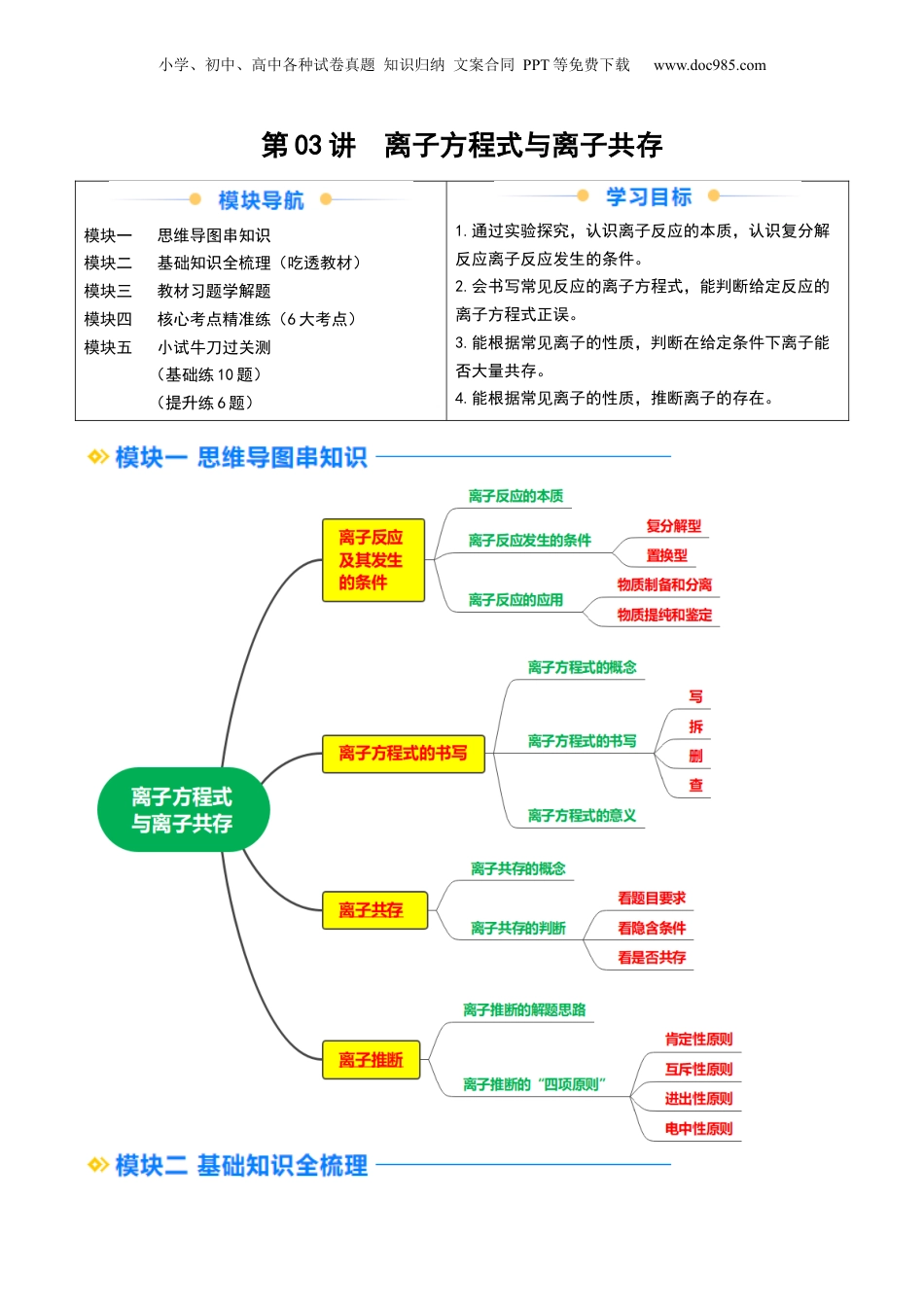
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第03讲离子方程式与离子共存模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(6大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.通过实验探究,认识离子反应的本质,认识复分解反应离子反应发生的条件。2.会书写常见反应的离子方程式,能判断给定反应的离子方程式正误。3.能根据常见离子的性质,判断在给定条件下离子能否大量共存。4.能根据常见离子的性质,推断离子的存在。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com一、离子反应及其发生的条件1.离子反应(1)探究离子反应的实质向盛有2mLNa2SO4稀溶液的试管中加入2mLBaCl2稀溶液。实验现象:①有生成;化学方程式:②Na2SO4+BaCl2===BaSO4↓+2NaCl;微观分析③BaCl2和Na2SO4的电离方程式BaCl2===、Na2SO4===混合前两种溶液中的离子BaCl2溶液:Na2SO4溶液:混合后数目减少的离子混合后数目不变的离子反应实质结合生成白色沉淀(2)概念:电解质在溶液中的反应实质上是之间的反应,这样的反应属于离子反应。(3)实质:从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中①的反应。离子反应使溶液中某些离子的浓度②。2.离子反应发生的条件(1)复分解型离子反应(2)置换型离子反应溶液中有离子参加的置换反应,如活泼金属与酸(锌与稀H2SO4)、活泼金属与盐(铁与CuSO4溶液)的反应等。3.离子反应的应用离子反应在、,以及消除水中污染物等方面都有广泛的应用。二、离子方程式的书写1.离子方程式的概念用实际参加反应的来表示反应的式子。如:Na2SO4溶液和BaCl2溶液反应的离子方程式可表示为Ba2++SO===BaSO4↓。2.离子方程式的书写以氯化钡和硫酸钠在溶液中的反应为例:(1)写:化学方程式(必须根据实验事实):。(2)拆:把易溶于水且易电离的物质拆成离子的形式:小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com。(3)删:删去方程式两边不参加反应的离子,并将方程式化为最简:。(4)查:检查离子方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。【方法技巧】离子方程式中的拆与不拆“”“”(1)能拆写成离子的物质拆(2)不能拆写成离子的物质不拆(3)特殊物质的拆与不拆在溶液中的①NaHSO4应拆写成Na+、H+和SO的形式,NaHCO3应拆写成Na+和HCO的形式。对微溶物,如②Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。3.离子方程式的意义写出下列反应的化学方程式和离子方程式。溶液中反应物化学方程式离子方程式盐酸与氢氧化钠盐酸与氢氧化钾硫酸与氢氧化钠总结离子方程式不仅可以表示某个具体的化学反应,还可以表示的离子反应。【方法技巧】离子方程式的正误判断(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。如铁与稀硫酸的反应不能写成2Fe+6H+===2Fe3++3H2↑,应写成Fe+2H+===Fe2++H2↑。(2)看各物质的化学式拆写是否正确。如石灰石与稀盐酸的反应不能写成CO+2H+===H2O+CO2↑,应写成CaCO3+2H+===Ca2++H2O+CO2↑。注意:微溶物在生成物中当成沉淀,不拆写,若为反应物且为澄清溶液则拆成离子,如Ca(OH)2。(3)看是否漏写参加反应的离子。如硫酸铜溶液和氢氧化钡溶液的反应,离子方程式不能写成SO+Ba2+===BaSO4↓,应写成Cu2++SO+Ba2++2OH-===Cu(OH)2↓+BaSO4↓。(4)看原子和电荷是否守恒。如Cu与AgNO3溶液反应的离子方程式不能写成Cu+Ag+===Cu2++Ag,而应写成Cu+2Ag+===Cu2++2Ag。(5)看反应物或生成物的配比是否正确。如稀硫酸与Ba(OH)2溶液的反应不能写成H++OH-+SO+Ba2+===BaSO4↓+H2O,应写成2H++2OH-+SO+Ba2+===BaSO4↓+2H2O。(6)看所用连接符号与生成物状态符号是否正确。离子互换反应的方程式通常用“=”号连接,生成沉淀或气体则标出或符号。“↑”“↓”三、离子共存1.离子共存的概念小学、初中、高中各种试卷真题...