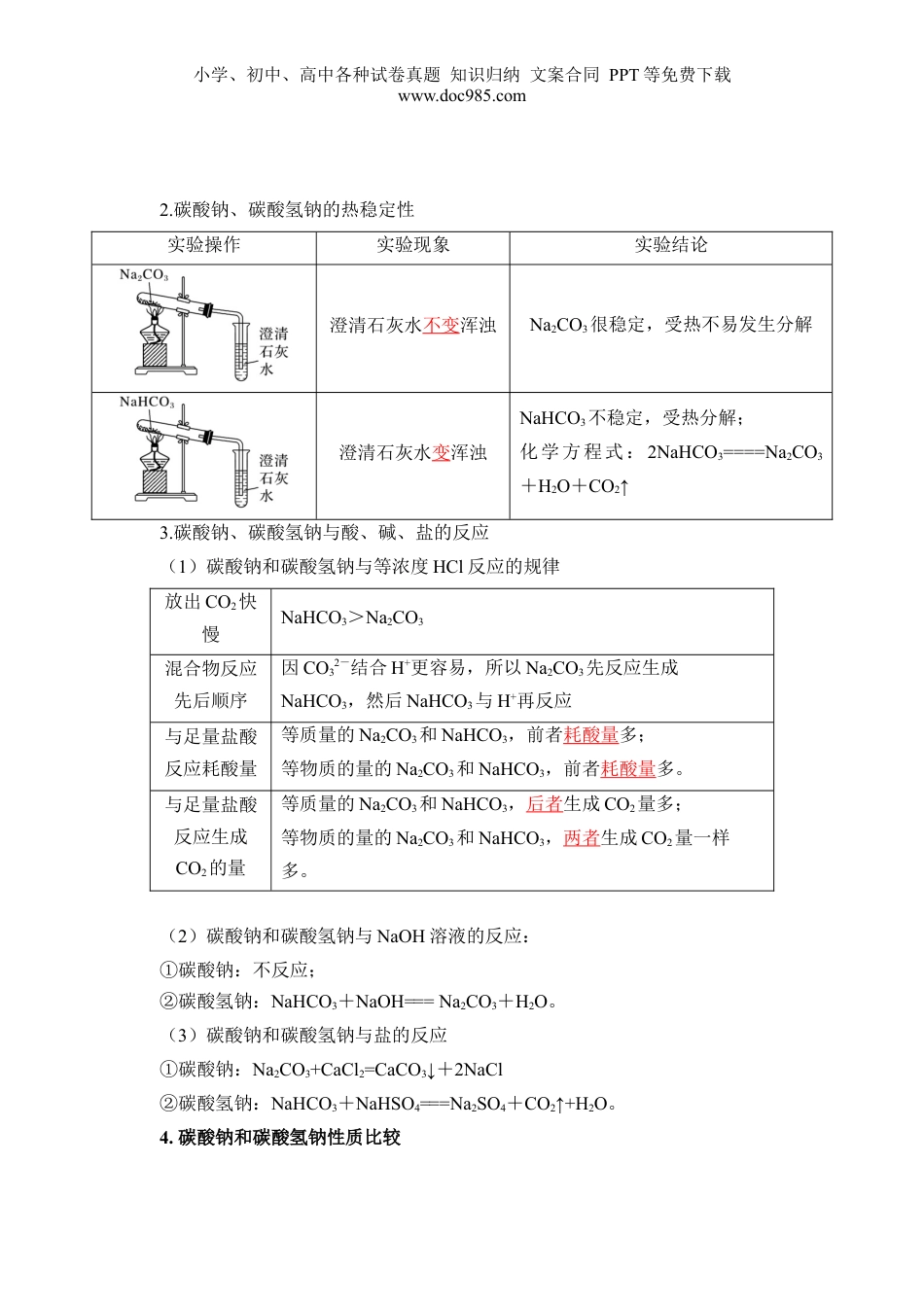
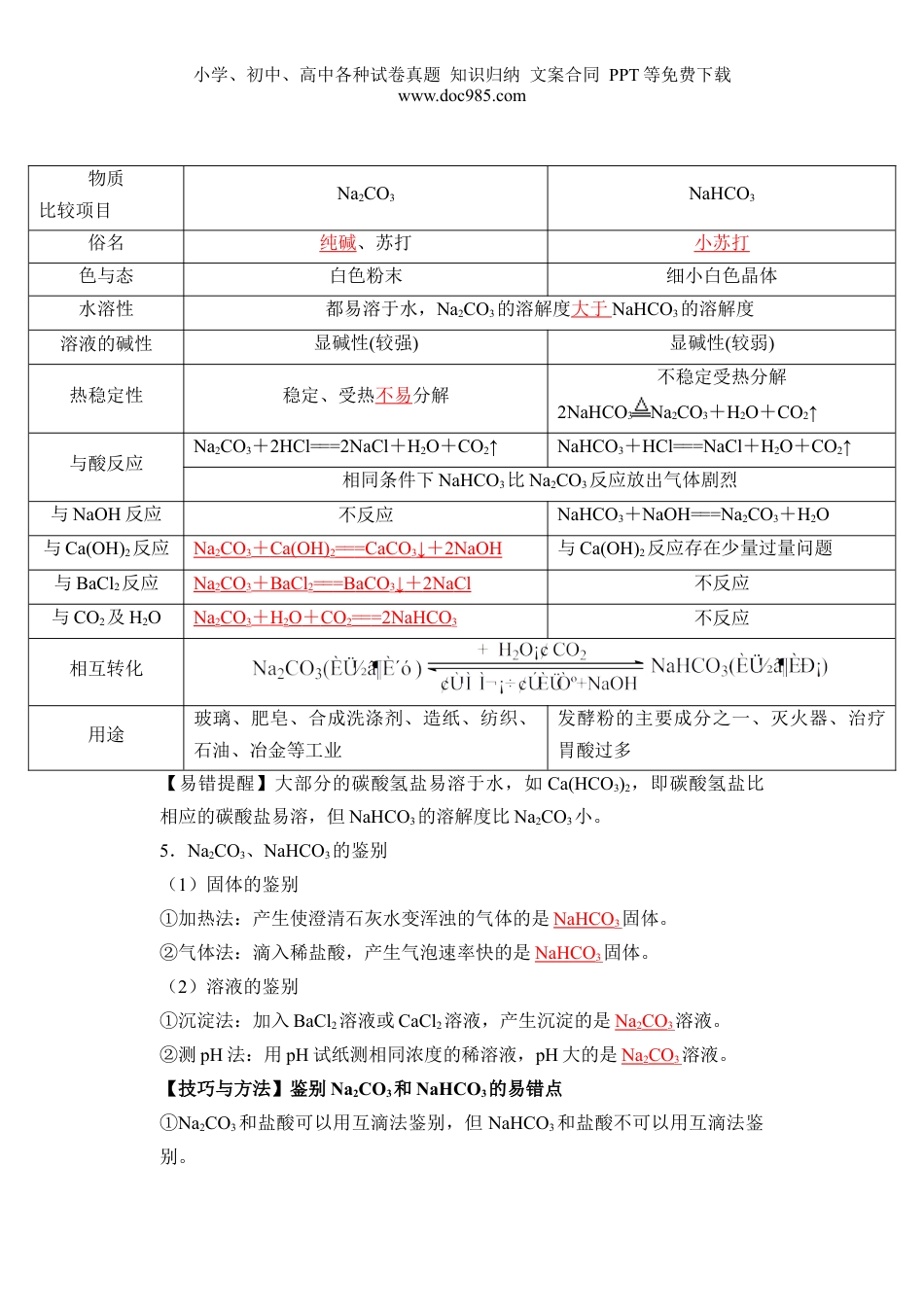
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第06讲碳酸钠和碳酸氢钠焰色试验1.通过实验探究,结合盐的通性认识碳酸钠和碳酸氢钠的化学性质。2.了解碳酸钠与碳酸氢钠在生产、生活中的应用及与性质的关系。3.学会用焰色试验鉴别K+、Na+等离子。一、碳酸钠和碳酸氢钠1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究操作Na2CO3NaHCO3(1)观察外观并进行描述白色粉末细小的白色晶体(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化粉末结块变成晶体;放热,温度计的示数明显升高晶体部分溶解;吸热,温度计的示数降低(3)继续向(2)的试管中分别加入5mL水,用力振荡,有何现象完全溶解部分溶解(4)分别向(3)所得的溶液中滴入1~2滴酚酞溶液,有何现象溶液变红色溶液变微红色初步结论加水先变成含结晶水的晶体(Na2CO3·xH2O),溶液碱性比NaHCO3强加水部分溶解,溶液碱性比Na2CO3弱小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2.碳酸钠、碳酸氢钠的热稳定性实验操作实验现象实验结论澄清石灰水不变浑浊Na2CO3很稳定,受热不易发生分解澄清石灰水变浑浊NaHCO3不稳定,受热分解;化学方程式:2NaHCO3====Na2CO3+H2O+CO2↑3.碳酸钠、碳酸氢钠与酸、碱、盐的反应(1)碳酸钠和碳酸氢钠与等浓度HCl反应的规律放出CO2快慢NaHCO3>Na2CO3混合物反应先后顺序因CO32-结合H+更容易,所以Na2CO3先反应生成NaHCO3,然后NaHCO3与H+再反应与足量盐酸反应耗酸量等质量的Na2CO3和NaHCO3,前者耗酸量多;等物质的量的Na2CO3和NaHCO3,前者耗酸量多。与足量盐酸反应生成CO2的量等质量的Na2CO3和NaHCO3,后者生成CO2量多;等物质的量的Na2CO3和NaHCO3,两者生成CO2量一样多。(2)碳酸钠和碳酸氢钠与NaOH溶液的反应:①碳酸钠:不反应;②碳酸氢钠:NaHCO3+NaOH===Na2CO3+H2O。(3)碳酸钠和碳酸氢钠与盐的反应①碳酸钠:Na2CO3+CaCl2=CaCO3↓+2NaCl②碳酸氢钠:NaHCO3+NaHSO4===Na2SO4+CO2↑+H2O。4.碳酸钠和碳酸氢钠性质比较小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com物质比较项目Na2CO3NaHCO3俗名纯碱、苏打小苏打色与态白色粉末细小白色晶体水溶性都易溶于水,Na2CO3的溶解度大于NaHCO3的溶解度溶液的碱性显碱性(较强)显碱性(较弱)热稳定性稳定、受热不易分解不稳定受热分解2NaHCO3Na2CO3+H2O+CO2↑与酸反应Na2CO3+2HCl===2NaCl+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑相同条件下NaHCO3比Na2CO3反应放出气体剧烈与NaOH反应不反应NaHCO3+NaOH===Na2CO3+H2O与Ca(OH)2反应Na2CO3+Ca(OH)2===CaCO3↓+2NaOH与Ca(OH)2反应存在少量过量问题与BaCl2反应Na2CO3+BaCl2===BaCO3↓+2NaCl不反应与CO2及H2ONa2CO3+H2O+CO2===2NaHCO3不反应相互转化用途玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业发酵粉的主要成分之一、灭火器、治疗胃酸过多【易错提醒】大部分的碳酸氢盐易溶于水,如Ca(HCO3)2,即碳酸氢盐比相应的碳酸盐易溶,但NaHCO3的溶解度比Na2CO3小。5.Na2CO3、NaHCO3的鉴别(1)固体的鉴别①加热法:产生使澄清石灰水变浑浊的气体的是NaHCO3固体。②气体法:滴入稀盐酸,产生气泡速率快的是NaHCO3固体。(2)溶液的鉴别①沉淀法:加入BaCl2溶液或CaCl2溶液,产生沉淀的是Na2CO3溶液。②测pH法:用pH试纸测相同浓度的稀溶液,pH大的是Na2CO3溶液。【技巧与方法】鉴别Na2CO3和NaHCO3的易错点①Na2CO3和盐酸可以用互滴法鉴别,但NaHCO3和盐酸不可以用互滴法鉴别。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com②鉴别Na2CO3和NaHCO3时,不能用NaOH溶液(虽然前者不反应后者反应,均无明显现象),也不能用澄清的石灰水或Ba(OH)2溶色液,均产生白色沉淀。6.Na2CO3和NaHCO3的检验(1)步骤①向溶液中加入足量的BaCl2溶液或CaCl2溶液,过滤②分别向沉淀和滤液中加入足量的稀盐酸③将产生的气体依次通过品红溶液和澄清石灰水(2)现象及结论:品红溶液不褪色,澄清石灰水变浑浊①沉淀上产生该现象:原溶液...