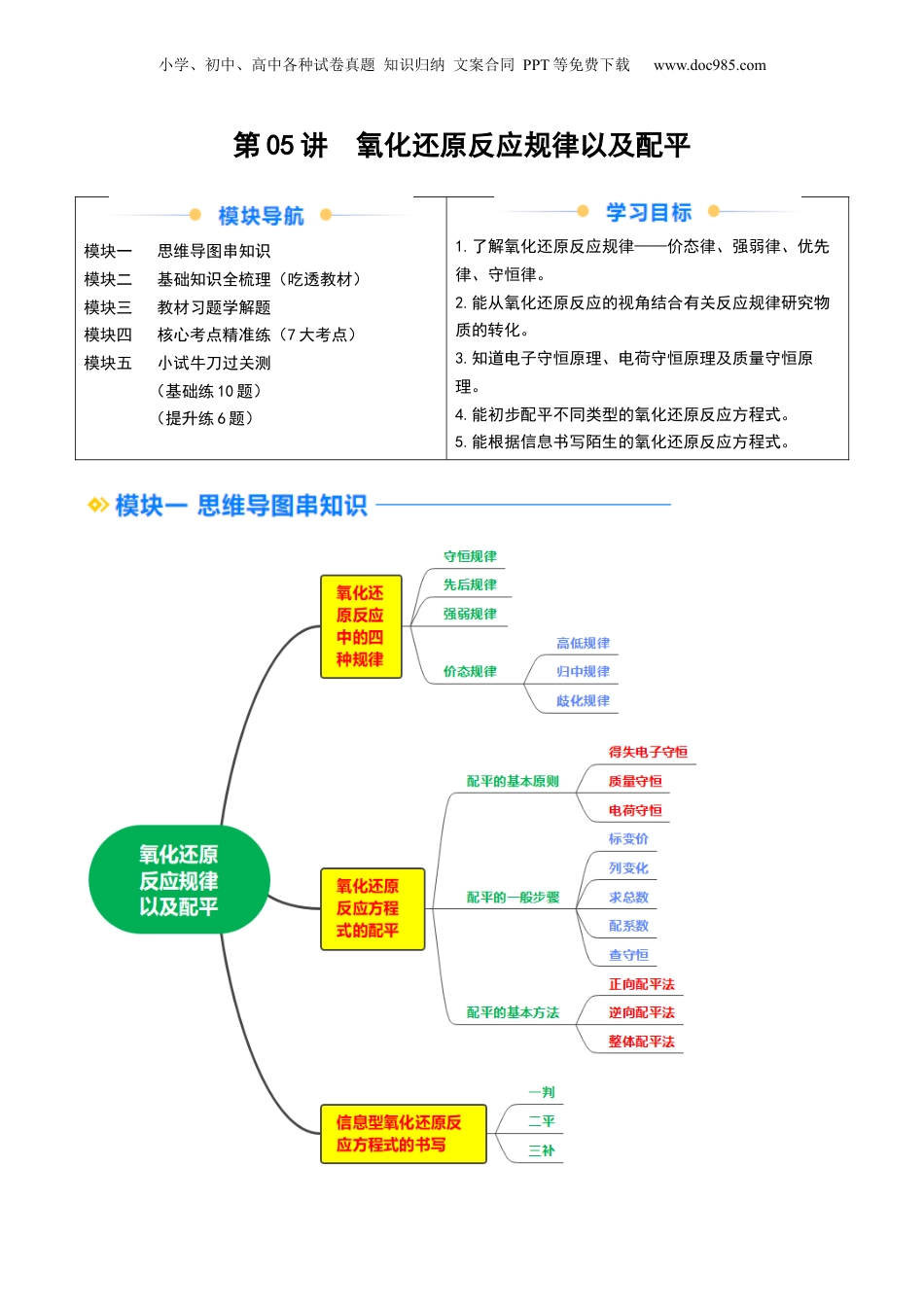
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第05讲氧化还原反应规律以及配平模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(7大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.了解氧化还原反应规律——价态律、强弱律、优先律、守恒律。2.能从氧化还原反应的视角结合有关反应规律研究物质的转化。3.知道电子守恒原理、电荷守恒原理及质量守恒原理。4.能初步配平不同类型的氧化还原反应方程式。5.能根据信息书写陌生的氧化还原反应方程式。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com一、氧化还原反应中的四种规律1.守恒规律氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:还原剂失电子的总数=氧化剂得电子的总数。元素化合价降低的总数=元素化合价升高的总数。2.价态规律(1)高低规律元素处于最高价态时,只有氧化性;元素处于中间价态时,既有氧化性又有还原性;元素处于最低价态时,只有还原性,即高价氧,低价还,中间价态两边转。“”(2)归中规律同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即只靠拢,不交叉就“”“近变价。”如:H2S中S元素为-2价,与生成物中单质S的0价近,所以H2S生成S。(3)歧化规律氧化还原反应中,有原子化合价升高,必然有原子化合价降低。某物质发生歧化反应时,中间价态―→高价态+低价态。(4)同种元素相邻价态不发生氧化还原反应规律如Fe3+和Fe2+不反应,H2SO4和SO2不反应等。3.强弱规律还原剂+氧化剂===氧化产物+还原产物(强还原性)(强氧化性)(弱氧化性)(弱还原性)还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物。即强制弱或前强后弱。“”“”应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)和有还原性(或氧化性)的物质在一定条件下能否发生反应。4.先后规律(1)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。(2)同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com二、氧化还原反应方程式的配平1.配平的基本原则(1)得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。(2)质量守恒:反应前后原子的种类和个数不变。(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。2.配平的一般步骤(1)标变价:写出反应物和生成物的化学式,标出反应前后变价元素的化合价。C+HNO3(浓)——NO2↑+CO2↑+H2O(2)列变化:标出反应前后元素化合价的变化值。(3)求总数:通过求最小公倍数使化合价升降总数相等。(4)配系数:确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,观察法配平其他物质的化学计量数。C+4HNO3(浓)——4NO2↑+CO2↑+2H2O(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。C+4HNO3(浓)=====4NO2↑+CO2↑+2H2O2.配平的基本方法(1)正向配平法适合反应物分别是氧化剂、还原剂的反应。如:(2)逆向配平法适用于一种元素的化合价既升高又降低的反应和分解反应中的氧化还原反应。先确定生成物的化学计量数,然后确定反应物的化学计量数。如:3S+6KOH(热、浓)===2K2S+K2SO3+3H2O化合价降低2×2化合价升高4由于S的化合价既升高又降低,而且升降总数要相等,所以K2S的化学计量数为2,K2SO3的化学计量数为1,然后确定S的化学计量数为3。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(3)整体配平法若某一氧化还原反应中,有三种元素的化合价发生了变...