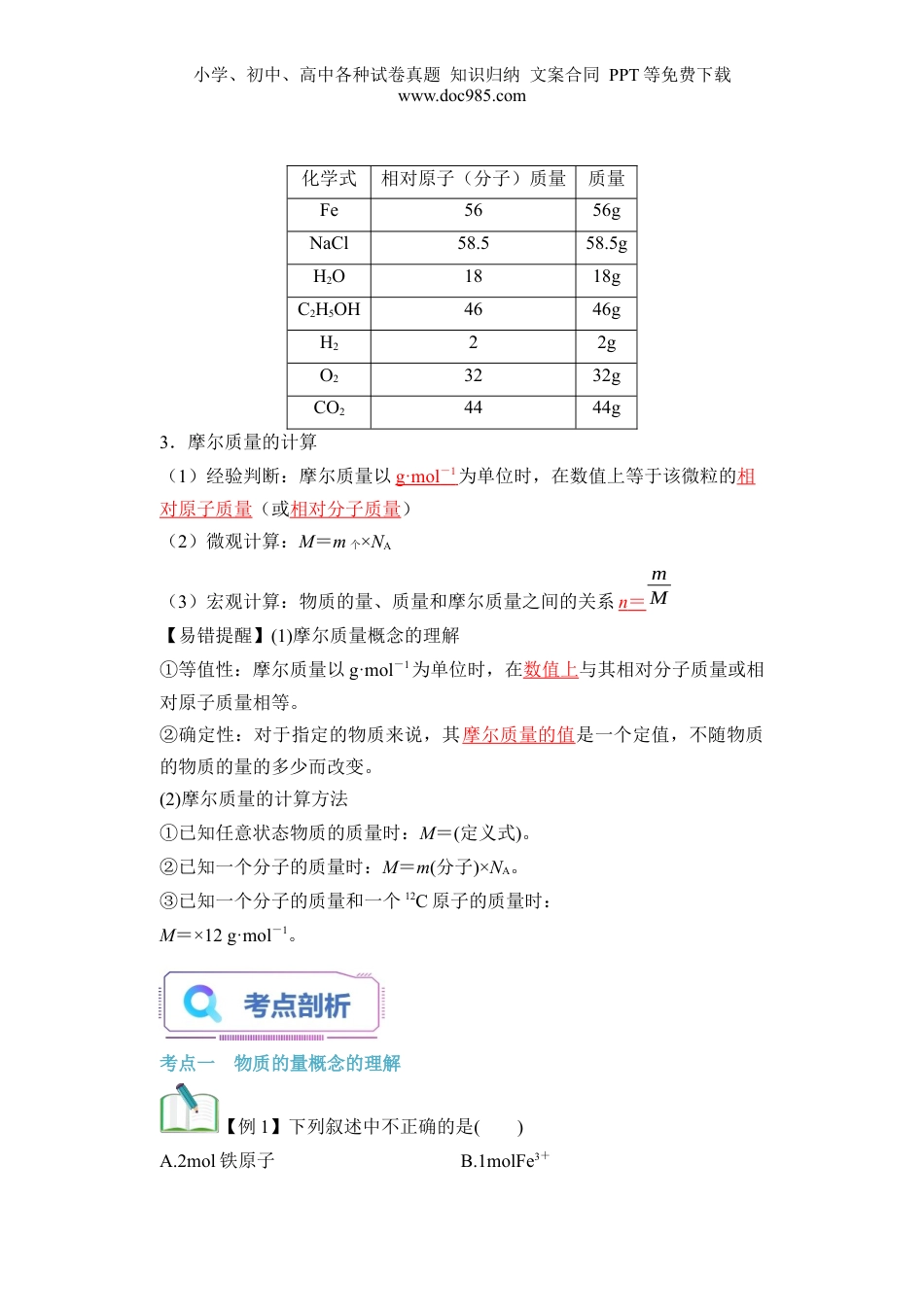
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第09讲物质的量摩尔质量1.了解物质的量及其单位——摩尔,了解物质的量与微观粒子数之间的关系。从物质的量的角度来认识物质的微观构成。2.从物质的量与微观粒子之间的关系,能够运用物质的量、摩尔质量、阿伏加德罗常数的相互关系进行简单计算。3.体会以内物质的量的概念对化学科学的重要作用。一、物质的量的单位——摩尔1.物质的量(1)概念:表示含有一定数目粒子的集合体的基本物理量,符号为_n_。它是国际单位制中的七个基本物理量之一。国际单位制(SI)中的七个基本单位物理量长度质量时间电流热力学温度物质的量发光强度单位(符号)米(m)千克(kg)秒(s)安(A)开(K)摩(mol)坎(cd)(2)单位:摩尔,简称摩,符号为mol。数值规定:1mol粒子集合体所含的粒子数约为6.02×1023,即1mol任何粒子集合体都含有约6.02×1023个粒子。如1molO2中约含6.02×1023个O2,约含2×6.02×1023个O。(3)书写方法及含义表述微观粒子的物质的量时,必须指明微观粒子的种类:如1molH指1mol氢原子,1molH2指1mol氢分子。(4)应用范围:微观粒子,如分子、原子、离子、原子团、质子、中子、电子等或其特定组合。(5)意义:把物质的宏观量和微观粒子的数量联系起来。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【“四化”理解物质的量】专有化“物质的量”四个字是一个整体,不能拆开,也不能添字,如不能说成“物质量”或“物质的数量”等微观化只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等及这些粒子的特定组合,如NaCl;不能表示宏观的物质,如苹果具体化必须指明具体粒子的种类,如“1molO”、“2molO2”、“1.5molO3”,不能说“1mol氧”集体化物质的量可以表示多个微粒的特定组合或集合体,如“1molNaCl”、“0.5molH2SO4”二、阿伏加德罗常数1.概念:1mol任何粒子的粒子数,符号为NA,通常用6.02×1023_mol-1表示。2.单位:mol-1。3.物质的量(n)、阿伏加德罗常数(NA)与微粒数目(N)的关系。(1)关系式:n=。(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比。【易错点拨】(1)阿伏加德罗常数——“三量”基准量0.012kg12C中所含的碳原子数准确量是一个物理量,用NA表示,单位是mol-1近似量6.02×1023mol-1(2)NA指1mol任何微粒的微粒数,一定要明确指出是何种微粒,如1molCH4含有的分子数为NA,原子总数为5NA。(3)涉及稀有气体时要注意He、Ne、Ar为单原子分子,O2、N2、H2等为双原子分子,臭氧(O3)为三原子分子等。三、摩尔质量1.概念:单位物质的量的物质所具有的质量叫作摩尔质量。2.符号和单位:摩尔质量的符号为M;单位为g·mol-1。【思考与分析】根据下表数据,你可以得到什么结论?1mol不同物质的质量小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com化学式相对原子(分子)质量质量Fe5656gNaCl58.558.5gH2O1818gC2H5OH4646gH222gO23232gCO24444g3.摩尔质量的计算(1)经验判断:摩尔质量以g·mol-1为单位时,在数值上等于该微粒的相对原子质量(或相对分子质量)(2)微观计算:M=m个×NA(3)宏观计算:物质的量、质量和摩尔质量之间的关系n=mM【易错提醒】(1)摩尔质量概念的理解①等值性:摩尔质量以g·mol-1为单位时,在数值上与其相对分子质量或相对原子质量相等。②确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。(2)摩尔质量的计算方法①已知任意状态物质的质量时:M=(定义式)。②已知一个分子的质量时:M=m(分子)×NA。③已知一个分子的质量和一个12C原子的质量时:M=×12g·mol-1。考点一物质的量概念的理解【例1】下列叙述中不正确的是()A.2mol铁原子B.1molFe3+小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comC.0.5mol氧D.0.5mol氮气【答案】C【解析】0.5mol氧,是指0.5mol氧气还是0.5mol氧原子不清楚,指代不明确,故C错误。【归纳总结】(1)某微粒的物质的量,用“n(微粒符号)”表示。例如:n(O2)、n(H2O)、n(Na+)等。(2)粒子集...