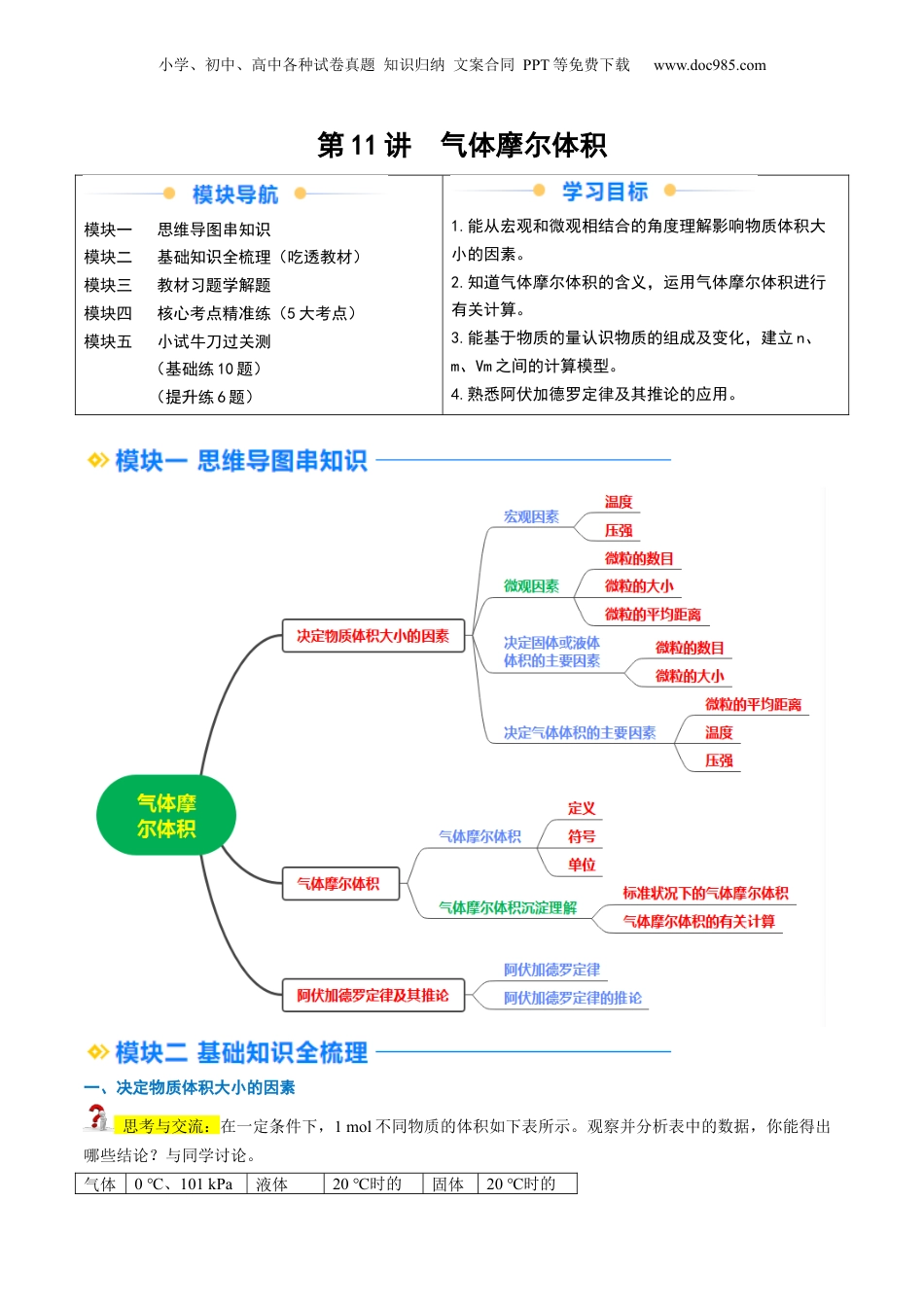
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第11讲气体摩尔体积模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(5大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.能从宏观和微观相结合的角度理解影响物质体积大小的因素。2.知道气体摩尔体积的含义,运用气体摩尔体积进行有关计算。3.能基于物质的量认识物质的组成及变化,建立n、m、Vm之间的计算模型。4.熟悉阿伏加德罗定律及其推论的应用。一、决定物质体积大小的因素思考与交流:在一定条件下,1mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出哪些结论?与同学讨论。气体0℃、101kPa液体20℃时的固体20℃时的小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com时的体积/L体积/cm3体积/cm3H222.4H2O18.0Fe7.12O222.4H2SO453.6Al10.0【答案】(1)同温同压下,1mol气体的体积近似相等,在标准状况下约为22.4L。(2)同温同压下,1mol不同的固态物质或液态物质的体积不相同(或差别较大)。1.决定物质体积大小的因素(1)宏观因素:温度、压强(2)微观因素:微粒的数目、微粒的大小、微粒的平均距离(3)决定固体或液体体积的主要因素:微粒的数目、微粒的大小(4)决定气体体积的主要因素:微粒的平均距离、温度、压强思考与交流:在同温同压下,粒子数相同的不同固态或液态物质的体积为什么不相同?【答案】固态、液态物质的体积主要取决于粒子大小和粒子数目,粒子数目相同的不同物质的粒子大小不同,体积不同。二、气体摩尔体积1.气体摩尔体积(1)定义:单位物质的量的物质所占的体积(2)符号:Vm(3)单位:L·mol-1.m3·mol-1(4)物质的量(n)、气体摩尔体积(Vm)、气体体积(V)的关系:V=n·Vm①气体摩尔体积的数值与温度和压强有关②温度和压强一定时,1mol任何气体的体积都约为一个定值③说明了温度和压强以及气体的物质的量共同决定了气体的体积,而气体分子本身的大小对气体体积的影响很小④气体摩尔体积比标准状况下气体摩尔体积的范围广(5)标准状况数值:22.4L·mol-1,即在标准状况(1.01×105Pa,273K),1mol任何气体体积约为22.4L。2.理解气体摩尔体积应注意的几个问题(1)标准状况下的气体摩尔体积Vm=22.4L·mol-1,非标准状况时不能使用。(2)n=,只适用于气态物质(单一或者混合气体),对于标准状况下的固态和液态物质(如水、酒精、碳、三氧化硫等),均不适用。【归纳总结】标准状况下,气体摩尔体积的有关计算小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com①气体的物质的量n=mol;②气体的摩尔质量M=Vm·ρ=22.4ρg·mol-1;③气体的分子数N=n·NA=·NA;④气体的质量m=n·M=·Mg。三、阿伏加德罗定律及其推论1.阿伏加德罗定律在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。【易错警示】①阿伏加德罗定律适用于任何气体,包括混合气体。②同温、同压、同体积、同分子数,四同相互制约,即三同定一同。“”“”思考与交流:在同温同压(以0℃,101kPa即标准状况为例)下,完成下列问题。①1molO2的体积是22.4L,2molH2的体积是44.8L,=。由此可推知:同温同压下,气体的体积之比等于其物质的量之比。②44.8LO2的物质的量是2mol,质量是64g,44.8LH2的物质的量是2mol,质量是4g,=。由此可推知:同温同压下,同体积的气体的质量之比等于其摩尔质量之比。③1molO2的质量是32g,体积是22.4L,ρ(O2)==g·L-1(列式不化简,下同)。1molH2的质量是2g,体积是22.4L,ρ(H2)==g·L-1。由此可推知:同温同压下,气体的密度之比等于其摩尔质量之比。在标准状况下,气体的密度=g·L-1。2.阿伏加德罗定律的推论相同条件结论语言叙述公式同温同压同温同压下,气体体积之比等于物质的量之比,等于分子数之比==同温同体积同温同体积下,气体压强之比等于物质的量之比,等于分子数之比==同温同压同温同压下,气体密度之比等于摩尔质量之比=教材习题01现有下列四种因素:①温度②压强③气体微粒数④气体微粒大小,...