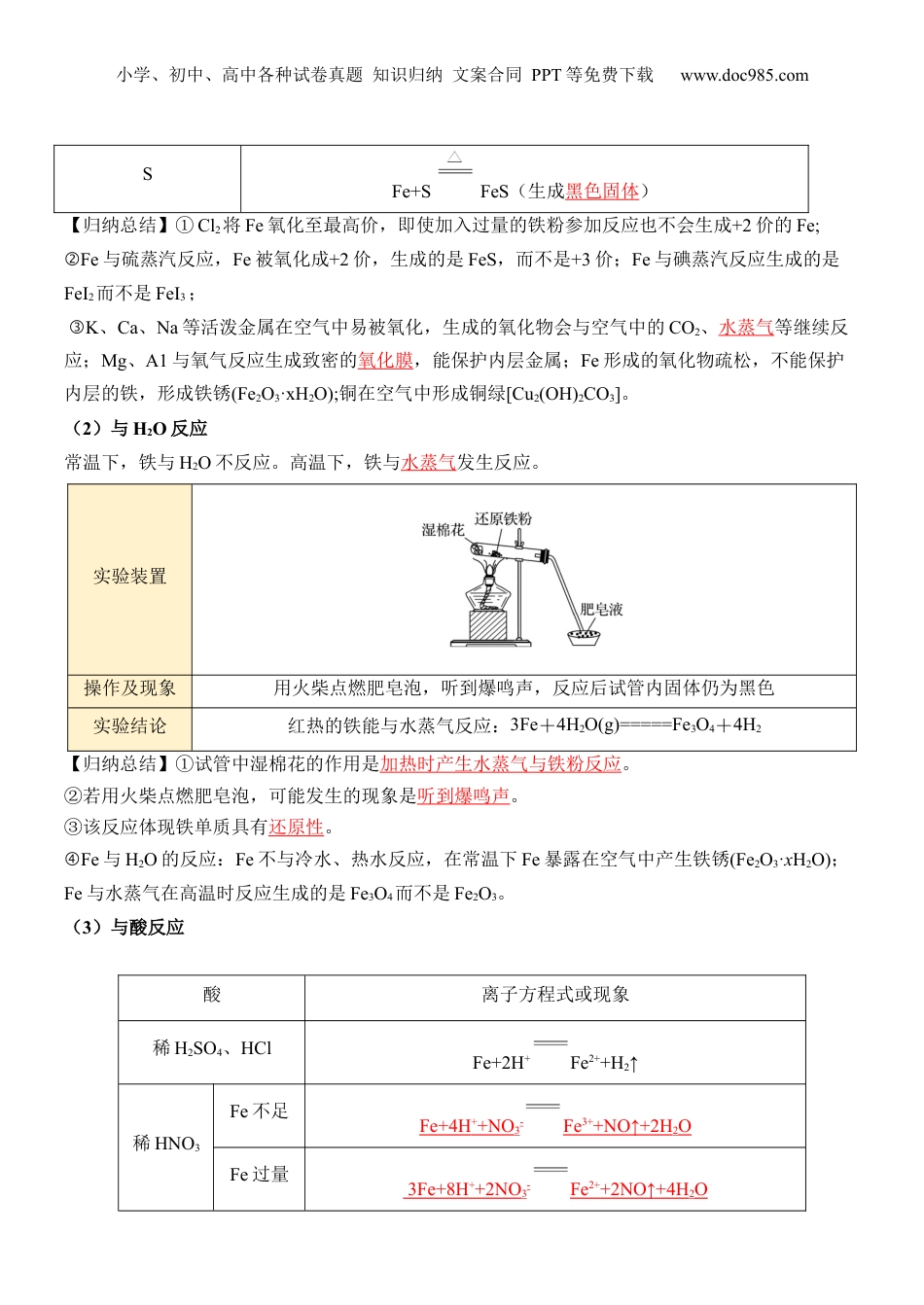
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第13讲铁和铁的氧化物1.知道铁在自然界中的存在形态。2.知道铁的物理性质,从氧化还原反应原理理解铁的化学性质。3.了解铁的氧化物类别、性质及应用,4.能从物质类别和铁元素化合价的角度认识铁及其化合物的性质,理清铁元素不同价态之间的转化关系,增强证据推理与模型认知的能力。一、铁的单质1.存在游离态陨铁中的铁以单质形态存在化合态以+2价和+3价化合物的形态存在2.物理性质纯净的铁是光亮的银白色金属,密度较大,熔点为1538℃。纯铁的抗腐蚀能力很强,具有良好的延展性和导热性,导电性比铜、铝差,能被磁铁吸引。3.化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。一般来说,铁单质与弱氧化剂反应,产生+2价铁;与强氧化剂反应产生+3价铁。(1)与非金属单质反应非金属单质化学反应方程式或现象O23Fe+2O2Fe3O4(剧烈燃烧,火星四射,生成黑色固体)Cl22Fe+3Cl2FeCl3(产生棕褐色烟)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comSFe+SFeS(生成黑色固体)【归纳总结】①Cl2将Fe氧化至最高价,即使加入过量的铁粉参加反应也不会生成+2价的Fe;②Fe与硫蒸汽反应,Fe被氧化成+2价,生成的是FeS,而不是+3价;Fe与碘蒸汽反应生成的是FeI2而不是FeI3;③K、Ca、Na等活泼金属在空气中易被氧化,生成的氧化物会与空气中的CO2、水蒸气等继续反应;Mg、A1与氧气反应生成致密的氧化膜,能保护内层金属;Fe形成的氧化物疏松,不能保护内层的铁,形成铁锈(Fe2O3·xH2O);铜在空气中形成铜绿[Cu2(OH)2CO3]。(2)与H2O反应常温下,铁与H2O不反应。高温下,铁与水蒸气发生反应。实验装置操作及现象用火柴点燃肥皂泡,听到爆鸣声,反应后试管内固体仍为黑色实验结论红热的铁能与水蒸气反应:3Fe+4H2O(g)=====Fe3O4+4H2【归纳总结】①试管中湿棉花的作用是加热时产生水蒸气与铁粉反应。②若用火柴点燃肥皂泡,可能发生的现象是听到爆鸣声。③该反应体现铁单质具有还原性。④Fe与H2O的反应:Fe不与冷水、热水反应,在常温下Fe暴露在空气中产生铁锈(Fe2O3·xH2O);Fe与水蒸气在高温时反应生成的是Fe3O4而不是Fe2O3。(3)与酸反应酸离子方程式或现象稀H2SO4、HClFe+2H+Fe2++H2↑稀HNO3Fe不足Fe+4H++NO3-Fe3++NO↑+2H2OFe过量3Fe+8H++2NO3-Fe2++2NO↑+4H2O小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【易错点拨】①铁遇冷的浓硝酸、浓硫酸时,表面会生成一层致密的氧化膜,化学上称之为钝化。铁的钝化是化学变化,而非物理变化。钝化条件——室温,如加热铁是可以反应的。②在铁与稀HNO3反应时,应考虑哪种物质过量然后再根据两种物质的量分析讨论判断,根据方程式:HNO3过量:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O;Fe过量:Fe+2Fe(NO3)3===3Fe(NO3)2(4)与盐反应:铁与硫酸铜溶液反应:Fe+Cu2+Fe2++Cu;铁与硫酸铁溶液反应:Fe+2Fe3+===3Fe2+二、铁的氧化物1.性质比较氧化物氧化亚铁氧化铁(铁红)四氧化三铁化学式FeOFe2O3Fe3O4颜色状态黑色粉末红棕色粉末黑色固体铁的价态+2+3+2、+3溶解性都不溶于水,但都能溶于酸溶液化学性质都能与稀盐酸、稀硫酸反应,生成相应的盐和水都具有氧化性,都能被CO、H2、Al等还原为铁单质FeO不稳定,在空气中加热生成稳定的Fe3O4【特别提醒】①Fe3O4的组成可用FeO·Fe2O3表示,但不代表Fe3O4是由FeO和Fe2O3组成的混合物,Fe3O4有固定的组成,是一种纯净物。②由于Fe3O4与非氧化性酸反应,生成铁盐和亚铁盐,故Fe3O4不属于碱性氧化物,而FeO、Fe2O3浓HNO3、浓H2SO4常温下钝化小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com属于碱性氧化物。③稳定性:FeO不稳定,Fe2O3和Fe3O4很稳定。2.典型反应(1)分别写出盐酸与下列铁的氧化物反应的离子方程式:①氧化亚铁:FeO+2H+===Fe2++H2O;②氧化铁:Fe2O3+6H+===2Fe3++3H2O;③磁性氧化铁:Fe3O4+8H+===Fe2++2Fe3++4H2O。(2)氧化铁与铝粉在高温下可发生铝热反应,其化学方程式为2Al+Fe2O3=====2Fe+Al2O3,...