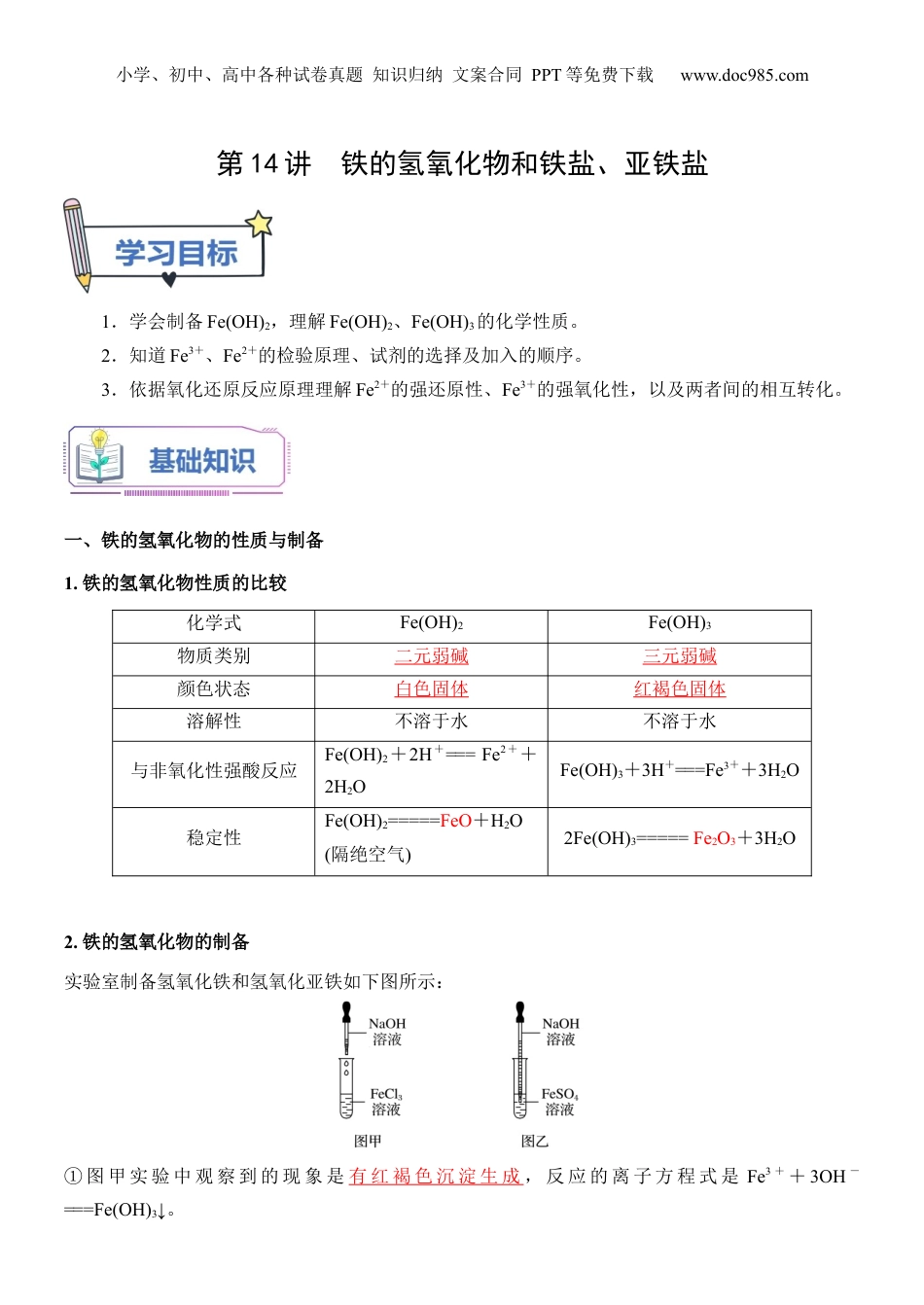
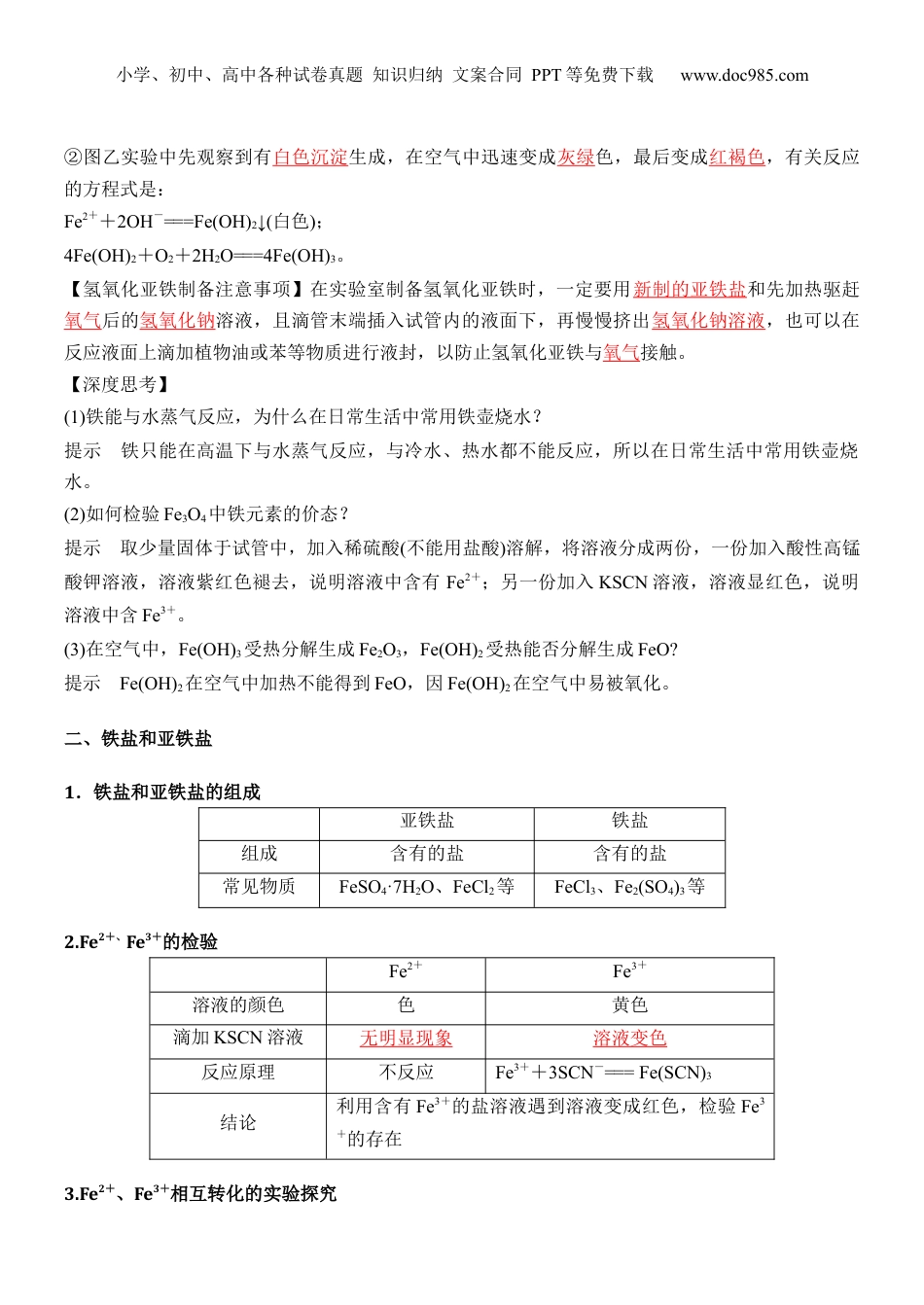
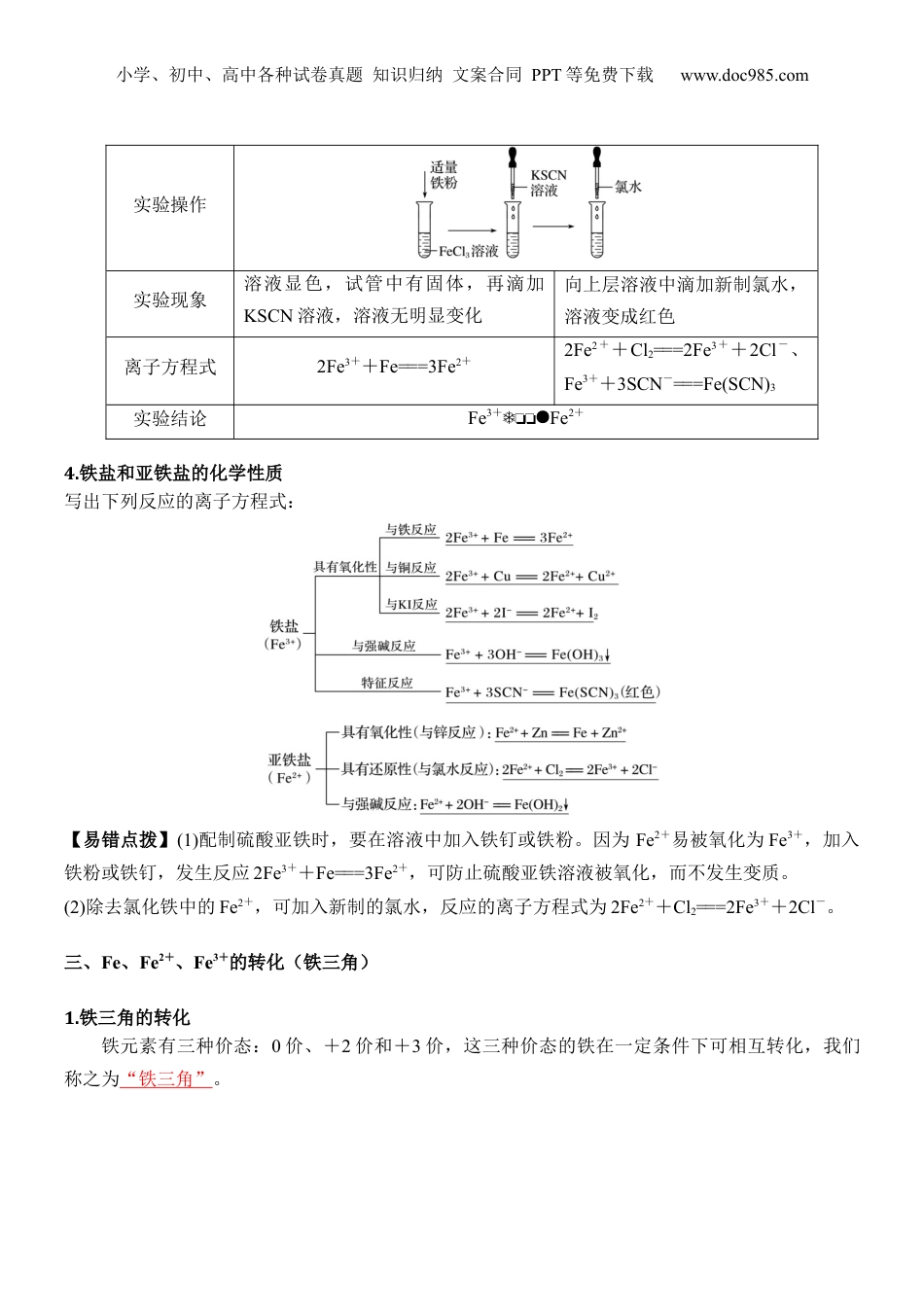
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第14讲铁的氢氧化物和铁盐、亚铁盐1.学会制备Fe(OH)2,理解Fe(OH)2、Fe(OH)3的化学性质。2.知道Fe3+、Fe2+的检验原理、试剂的选择及加入的顺序。3.依据氧化还原反应原理理解Fe2+的强还原性、Fe3+的强氧化性,以及两者间的相互转化。一、铁的氢氧化物的性质与制备1.铁的氢氧化物性质的比较化学式Fe(OH)2Fe(OH)3物质类别二元弱碱三元弱碱颜色状态白色固体红褐色固体溶解性不溶于水不溶于水与非氧化性强酸反应Fe(OH)2+2H+===Fe2++2H2OFe(OH)3+3H+===Fe3++3H2O稳定性Fe(OH)2=====FeO+H2O(隔绝空气)2Fe(OH)3=====Fe2O3+3H2O2.铁的氢氧化物的制备实验室制备氢氧化铁和氢氧化亚铁如下图所示:①图甲实验中观察到的现象是有红褐色沉淀生成,反应的离子方程式是Fe3++3OH-===Fe(OH)3↓。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com②图乙实验中先观察到有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色,有关反应的方程式是:Fe2++2OH-===Fe(OH)2↓(白色);4Fe(OH)2+O2+2H2O===4Fe(OH)3。【氢氧化亚铁制备注意事项】在实验室制备氢氧化亚铁时,一定要用新制的亚铁盐和先加热驱赶氧气后的氢氧化钠溶液,且滴管末端插入试管内的液面下,再慢慢挤出氢氧化钠溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以防止氢氧化亚铁与氧气接触。【深度思考】(1)铁能与水蒸气反应,为什么在日常生活中常用铁壶烧水?提示铁只能在高温下与水蒸气反应,与冷水、热水都不能反应,所以在日常生活中常用铁壶烧水。(2)如何检验Fe3O4中铁元素的价态?提示取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份,一份加入酸性高锰酸钾溶液,溶液紫红色褪去,说明溶液中含有Fe2+;另一份加入KSCN溶液,溶液显红色,说明溶液中含Fe3+。(3)在空气中,Fe(OH)3受热分解生成Fe2O3,Fe(OH)2受热能否分解生成FeO?提示Fe(OH)2在空气中加热不能得到FeO,因Fe(OH)2在空气中易被氧化。二、铁盐和亚铁盐1.铁盐和亚铁盐的组成亚铁盐铁盐组成含有的盐含有的盐常见物质FeSO4·7H2O、FeCl2等FeCl3、Fe2(SO4)3等2.Fe2+、Fe3+的检验Fe2+Fe3+溶液的颜色色黄色滴加KSCN溶液无明显现象溶液变色反应原理不反应Fe3++3SCN-===Fe(SCN)3结论利用含有Fe3+的盐溶液遇到溶液变成红色,检验Fe3+的存在3.Fe2+、Fe3+相互转化的实验探究小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com实验操作实验现象溶液显色,试管中有固体,再滴加KSCN溶液,溶液无明显变化向上层溶液中滴加新制氯水,溶液变成红色离子方程式2Fe3++Fe===3Fe2+2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3实验结论Fe3+Fe2+4.铁盐和亚铁盐的化学性质写出下列反应的离子方程式:【易错点拨】(1)配制硫酸亚铁时,要在溶液中加入铁钉或铁粉。因为Fe2+易被氧化为Fe3+,加入铁粉或铁钉,发生反应2Fe3++Fe===3Fe2+,可防止硫酸亚铁溶液被氧化,而不发生变质。(2)除去氯化铁中的Fe2+,可加入新制的氯水,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。三、Fe、Fe2+、Fe3+的转化(铁三角)1.铁三角的转化铁元素有三种价态:0价、+2价和+3价,这三种价态的铁在一定条件下可相互转化,我们称之为“铁三角”。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comFe只有还原性,可以被氧化成+2价或+3价铁①Fe能被Fe3+、Cu2+、H+、S等较弱氧化剂氧化为Fe2+②Fe能被Cl2、Br2、HNO3、浓H2SO4等强氧化剂氧化为Fe3+Fe2+既有氧化性又有还原性,主要表现还原性①还原性:Fe2+能被Cl2、O2、HNO3、H2O2、KMnO4(H+)等氧化为Fe3+②氧化性:Fe2+能被Zn、Al、CO、H2等还原为Fe,如:Fe2++Zn=Fe+Zn2+Fe3+具有较强的氧化性①能被Fe、Cu、S2-(H2S)、I-(HI)、SO2还原成Fe2+②能被C、CO、H2、Zn等还原成Fe,如:2Fe3++3Zn=2Fe+3Zn2+【易错点拨】Fe与稀HNO3:Fe少量,Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;如Fe过量...