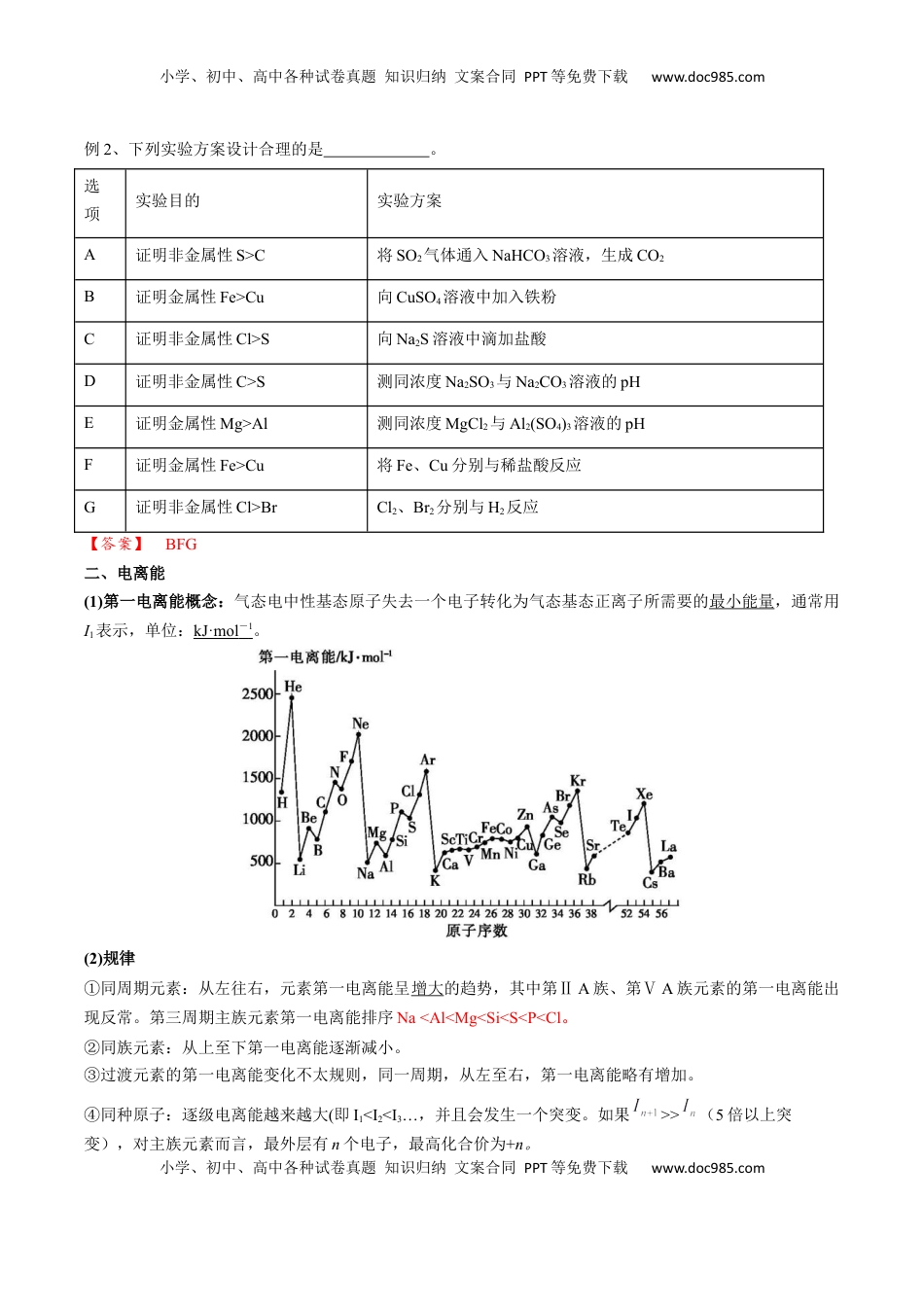
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【基础知识】原子结构与性质考点四元素周期律【必备知识】一、主族元素周期性变化规律1、原子结构与元素性质项目同周期(从左到右)同主族(从上到下)原子结构电子层数相同依次增加最外层电子数依次增加相同原子半径逐渐减小逐渐增大元素性质金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱化合价最高正化合价:+1→+7(O、F除外),负化合价=主族序数-8(H为-1价)相同,最高正化合价=主族序数(O、F除外)2、定性判断金属性、非金属性的一般方法金属性①单质与水或非氧化性酸反应制取氢气越容易,金属性越强②单质还原性越强或阳离子氧化性越弱,金属性越强③最高价氧化物对应水化物的碱性越强,金属性越强非金属性①与H2化合越容易,气态氢化物越稳定,非金属性越强②单质氧化性越强或阴离子还原性越弱,非金属性越强③最高价氧化物对应水化物的酸性越强,非金属性越强例1、根据元素周期律比较下列各组性质(用“>”或“<”填空):(1)金属性:K________Na________Mg;非金属性:F________O________S。(2)碱性:Mg(OH)2________Ca(OH)2______KOH。(3)酸性:HClO4________H2SO4________HClO。(4)热稳定性:CH4________NH3________H2O。(5)还原性:HBr________HCl,I-________S2-。(6)氧化性:Fe3+________Cu2+________Fe2+。【答案】(1)>>>>(2)<<(3)>>(4)<<(5)><(6)>>小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com例2、下列实验方案设计合理的是。选项实验目的实验方案A证明非金属性S>C将SO2气体通入NaHCO3溶液,生成CO2B证明金属性Fe>Cu向CuSO4溶液中加入铁粉C证明非金属性Cl>S向Na2S溶液中滴加盐酸D证明非金属性C>S测同浓度Na2SO3与Na2CO3溶液的pHE证明金属性Mg>Al测同浓度MgCl2与Al2(SO4)3溶液的pHF证明金属性Fe>Cu将Fe、Cu分别与稀盐酸反应G证明非金属性Cl>BrCl2、Br2分别与H2反应【答案】BFG二、电离能(1)第一电离能概念:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最小能量,通常用I1表示,单位:kJ·mol-1。(2)规律①同周期元素:从左往右,元素第一电离能呈增大的趋势,其中第ⅡA族、第ⅤA族元素的第一电离能出现反常。第三周期主族元素第一电离能排序Na<Al<Mg<Si<S<P<Cl。②同族元素:从上至下第一电离能逐渐减小。③过渡元素的第一电离能变化不太规则,同一周期,从左至右,第一电离能略有增加。④同种原子:逐级电离能越来越大(即I1<I2<I3…,并且会发生一个突变。如果>>(5倍以上突变),对主族元素而言,最外层有n个电子,最高化合价为+n。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com思考1:请结合核外电子排布相关知识解释,第一电离能:C小于O。【解析】碳原子半径比氧原子半径大,且核电荷数比氧的小,故碳原子对最外层电子的吸引力小于氧,第一电离能也小于氧。思考2:为什么第ⅡA族、第ⅤA族元素的第一电离能反常,以Be和B、N和O为例。【解析】Be的价电子排布式是2s2,为全充满结构,比较稳定,难失电子,而B的价电子排布为2s22p1,没有Be不稳定,因此失去第一个电子B比Be容易,第一电离能小。N原子的价电子排布式为2s22p3,处于半充满,比较稳定,难失电子,第一电离能大。思考3:已知电离能:I2(Ti)=1310kJ·mol-1,I2(K)=3051kJ·mol-1。为什么I2(Ti)<I2(K)。【解析】K+失去的是全充满的3p6上的电子,Ti+失去的是4s1上的电子,相对较易失去。例3、下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。I1I2I3I4……R7401500770010500下列关于元素R的判断中一定正确的是()A.R的最高正价为+3价B.R元素位于元素周期表中第ⅡB族C.R元素第一电离能大于同周期相邻元素D.R元素基态原子的电子排布式为1s22s2【答案】C【解析】由表中数据...