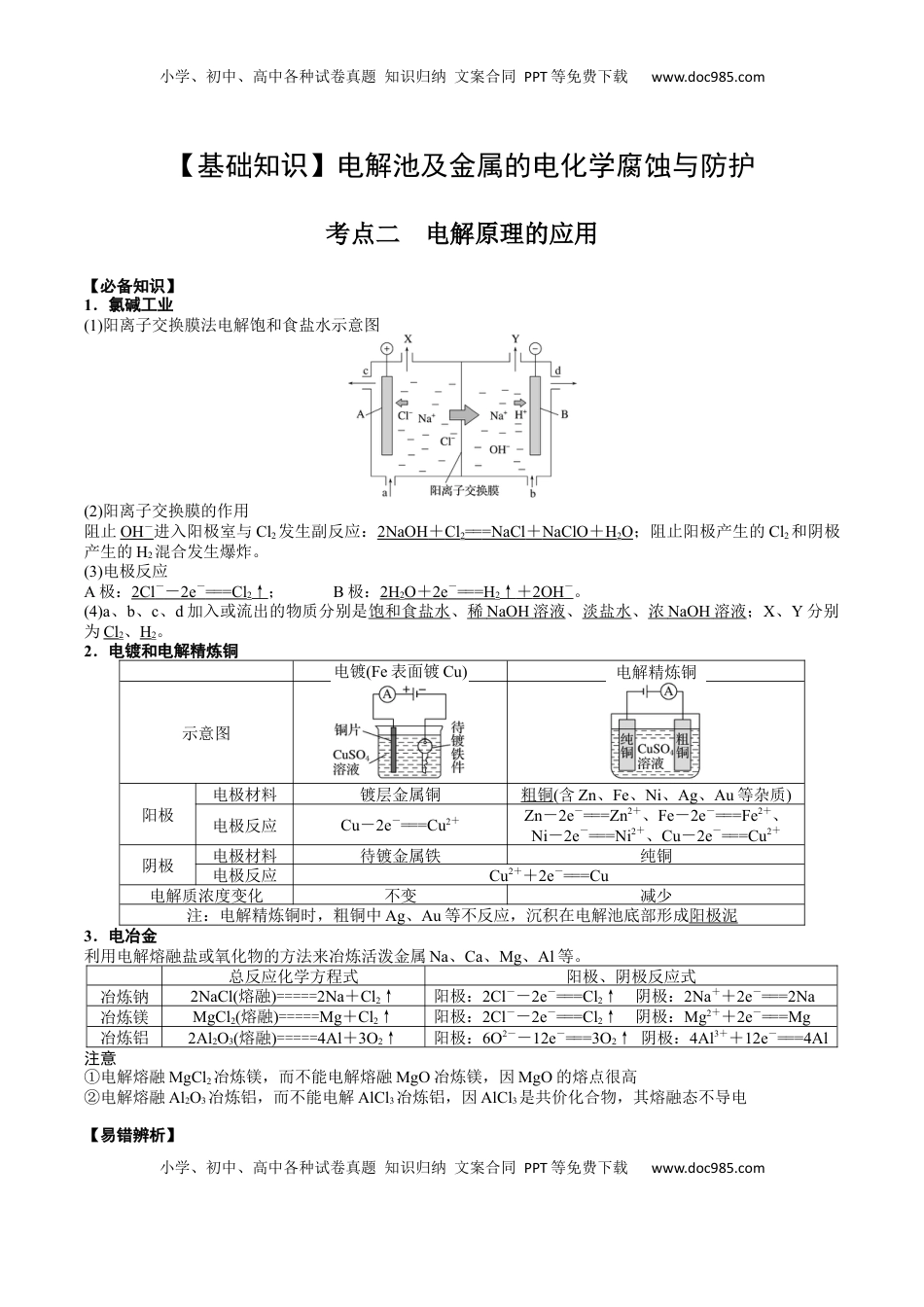
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【基础知识】电解池及金属的电化学腐蚀与防护考点二电解原理的应用【必备知识】1.氯碱工业(1)阳离子交换膜法电解饱和食盐水示意图(2)阳离子交换膜的作用阻止OH-进入阳极室与Cl2发生副反应:2NaOH+Cl2===NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。(3)电极反应A极:2Cl--2e-===Cl2↑;B极:2H2O+2e-===H2↑+2OH-。(4)a、b、c、d加入或流出的物质分别是饱和食盐水、稀NaOH溶液、淡盐水、浓NaOH溶液;X、Y分别为Cl2、H2。2.电镀和电解精炼铜电镀(Fe表面镀Cu)电解精炼铜示意图阳极电极材料镀层金属铜粗铜(含Zn、Fe、Ni、Ag、Au等杂质)电极反应Cu-2e-===Cu2+Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+阴极电极材料待镀金属铁纯铜电极反应Cu2++2e-===Cu电解质浓度变化不变减少注:电解精炼铜时,粗铜中Ag、Au等不反应,沉积在电解池底部形成阳极泥3.电冶金利用电解熔融盐或氧化物的方法来冶炼活泼金属Na、Ca、Mg、Al等。总反应化学方程式阳极、阴极反应式冶炼钠2NaCl(熔融)=====2Na+Cl2↑阳极:2Cl--2e-===Cl2↑阴极:2Na++2e-===2Na冶炼镁MgCl2(熔融)=====Mg+Cl2↑阳极:2Cl--2e-===Cl2↑阴极:Mg2++2e-===Mg冶炼铝2Al2O3(熔融)=====4Al+3O2↑阳极:6O2--12e-===3O2↑阴极:4Al3++12e-===4Al注意①电解熔融MgCl2冶炼镁,而不能电解熔融MgO冶炼镁,因MgO的熔点很高②电解熔融Al2O3冶炼铝,而不能电解AlCl3冶炼铝,因AlCl3是共价化合物,其熔融态不导电【易错辨析】小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.解和食水,均不能用金材料电饱盐时两个电极属()2.在件上,件接源的正镀电镀铜时镀应连电极()3.根据得失子守恒可知解精,少的量和增加的量相等电电炼铜时阳极减质阴极质()4.和解精,解溶液中电镀铜电炼铜时电质c(Cu2+)均保持不变()5.解冶、通常解熔融的电炼镁铝电MgCl2和Al2O3,也可以解熔融的电MgO和AlCl3()【答案】1.×2.×3.×4.×5.×【题型突破】1、(2014·上海)如下图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中。下列分析正确的是()A.K1闭合,铁棒上发生的反应为2H++2e-H2↑B.K1闭合,石墨棒周围溶液pH逐渐升高C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体【答案】B【详解】K1闭合形成原电池,铁作负极,失电子被腐蚀,石墨电极是正极,氧气得电子和水反应生成OH-,pH逐渐升高,A错误、B正确;K2闭合,铁棒作阴极被保护,不会被腐蚀,属于外加电流的阴极保护法,C错误;K2闭合形成电解池,两极分别产生氯气和氢气,电路中通过0.002NA个电子时,两极上分别产生0.001mol气体,共0.002mol气体,D错误。2、金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)()A.阳极发生还原反应,其电极反应式为Ni2++2e-===NiB.电解过程中,阳极质量的减少量与阴极质量的增加量相等C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中有Cu和Pt【答案】D【解析】电解时,阳极Zn、Fe、Ni失去电子,发生氧化反应,A项错误;因氧化性:Ni2+>Fe2+>Zn2+,故阴极的电极反应式为Ni2++2e-===Ni,阳极质量减少是因为Zn、Fe、Ni溶解,而阴极质量增加是因为Ni析出,二者不相等,B项错误;电解后溶液中的阳离子除Fe2+和Zn2+外,还有Ni2+和H+,C项错误。3、1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)=====O2↑+4Na↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH===Fe3O4+2H2↑+4Na↑。下列有关说法正确的是()A.戴维法制钠,阳极的电极反应式为Na++e-===Na↑B.盖·吕萨克法制钠原理是利用铁的金属性比钠的强C....