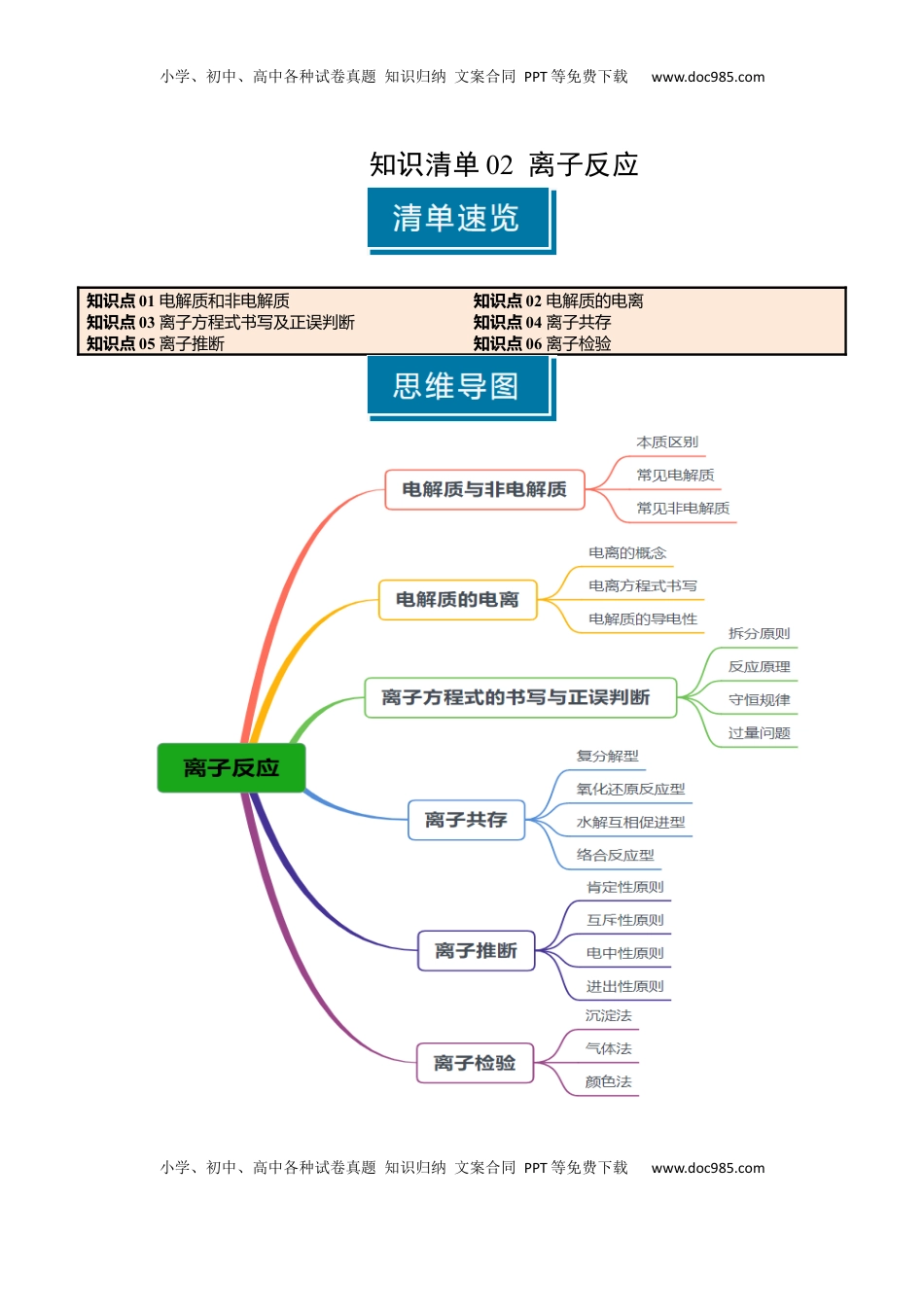
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单02离子反应知识点01电解质和非电解质知识点02电解质的电离知识点03离子方程式书写及正误判断知识点04离子共存知识点05离子推断知识点06离子检验小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01电解质和非电解质1.电解质和非电解质电解质和非电解质物质类别都是、本质区别看或状态能否导电导电条件出离子导电常见电解质、、、氧化物和常见非电解质CO2、NH3、乙醇、蔗糖2.强电解质和弱电解质强电解质和弱电解质本质区别是否完全强电解质不含溶质分子,含分子弱电解质溶质分子和溶质离子共存常见强电解质强酸、、、、、强碱大多数盐、(CH3COO)2Pb除外金属氧化物Na2O2、MgO、CaO等常见弱电解质弱酸、弱碱、少数盐和电解质的相关判断6个易错点(1)电解质和非电解质的概念是仅对于而言的,既不是电解质,也不是非电解质。(2)电解质导电,如固体NaCl、液态HCl均不导电;导电的物质是电解质,如金属单质、电解质溶液均可导电,但都不是电解质。(3)电解质是指能生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于,如CO2、SO2、NH3、SO3等非电解质,它们与水反应生成的产物H2CO3、H2SO3、NH3·H2O、H2SO4是电解质。(4)电解质的强弱是根据划分的,不能根据电解质溶液的导电性划分强弱电解质。也不能根据电解质的溶解性的划分强弱电解质。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(5)电解质的强弱与物质无关,溶解度小的物质易被误认为是电解质。如BaSO4、AgCl等在水溶液中溶解度很小,但溶解部分完全电离,因此属于强电解质。溶液导电性强弱与的浓度及离子所带的数有关,与电解质强弱无直接关系。(6)电解质溶于水和加热熔融时破坏的化学键不一定一样,溶于水破坏和某些,而加热熔融只破坏。1.判断正误(正确的打“√”,的打错误“×”)。(1)液氯不导电,氯水导电是因为氯气与水反应生成电解质电离而导电,故氯气是非电解质()(2)BaSO4的水溶液导电性很弱,故它是弱电解质()(3)二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质()(4)Cl2、SO2、NH3的水溶液均导电,故Cl2、SO2、NH3均为电解质()(5)CaCO3、AgCl难溶于水,所以是弱电解质()(6)强电解质溶液的导电性比弱电解质溶液的导电性强()(7)强电解质都是离子化合物,弱电解质都是共价化合物()(8)物质的量浓度都是0.1mol·L-1的NaCl溶液和CuSO4溶液导电能力相同()2.今有10种物质:①Cu②稀硫酸③HCl④NH3⑤空气⑥CO2⑦Hg⑧NaCl⑨CaCO3⑩Cl2按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。符合的条件物质的序号(1)混合物(2)电解质,但熔融状态下并不导电(3)电解质,但难溶于水(4)非电解质(5)既不是电解质,也不是非电解质,但本身能导电知识点02电解质的电离1.电离电离概念电解质在水溶液中或熔融状态下,离解成的过程条件或状态,不是“通电”表示电离方程式强电解质:用“”连接;小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com弱电解质:用“”连接2.电离方程式书写电离方程式书写的思维流程(1)强酸的酸式盐:如:NaHSO4水溶液熔融态(2)弱酸的酸式盐:完全电离出金属阳离子和酸根阴离子NaHCO3:K2HPO4:NH4HS:(3)多元弱酸分步电离,以第一步为主,不可合并H2CO3:、(4)多元弱碱分步电离,一步书写Fe(OH)3:(5)借水型电离NH3·H2O的电离:N2H4·H2O的电离:Al(OH)3酸式电离:(6)自偶电离一个分子失去H+,另一个分子得到H+H2O(l):NH3(l):HNO3(l):3.电解质的导电性(1)能导电性的物质①导电:金属单质和石墨(变化)②导电:电解质溶液和熔融电解...