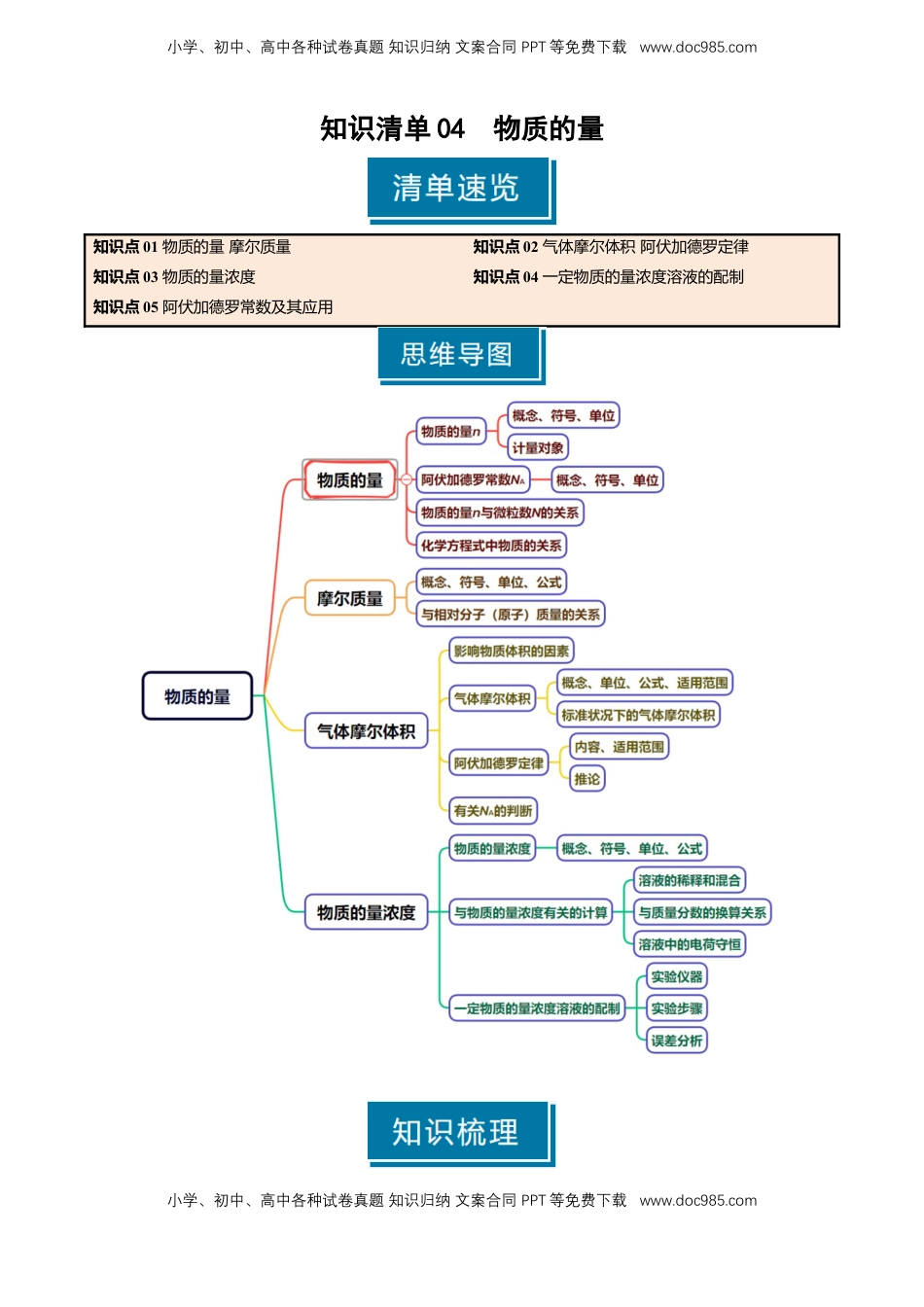
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单04物质的量知识点01物质的量摩尔质量知识点02气体摩尔体积阿伏加德罗定律知识点03物质的量浓度知识点04一定物质的量浓度溶液的配制知识点05阿伏加德罗常数及其应用小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01物质的量摩尔质量1.物质的量(1)概念:物质的量是国际单位制中的七个基本物理量之一,用来表示一定数目微粒的集合体。符号为n,单位是摩尔(mol)。(2)物质的量的规范表示方法(3)计量对象:mol可以计量微观粒子(包括分子、原子、离子、原子团、质子、中子、电子等)。2.阿伏加德罗常数(1)国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。(2)阿伏加德罗常数:1mol任何粒子的粒子数叫做阿伏加德罗常数。符号:NA,通常用6.02×1023mol-1表示。(3)物质的量、阿伏加德罗常数与微粒数目的关系:n=或N=n·NA或NA=推论:微粒之间的物质的量之比等于微粒的粒子数之比。3.摩尔质量(1)概念:单位物质的量的物质所具有的质量称为该物质的摩尔质量。符号为M。(2)常用单位:g·mol-1。(3)数值:当粒子或物质的摩尔质量以g·mol-1为单位时,在数值上等于该粒子的相对分子(或原子)质量。(4)公式:n=(5)摩尔质量的计算①根据物质的质量(m)和物质的量(n):M=。②已知一个分子的质量时:M=m(分子)×NA。③根据标准状况下气体的密度ρ:M=ρ×22.4L·mol-1。④根据气体的相对密度:D==。⑤对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%……指混合物中各成分的物质的量分数(或体积分数)。(1)物质的量是表示微粒数目多少的物理量(×)错因:物质的量是表示含有一定数目粒子的集合体的物理量。(2)1mol任何物质都含有6.02×1023个分子(×)错因:离子化合物不存在分子。(3)硫酸的摩尔质量为98g(×)错因:摩尔质量的单位是g·mol-1。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(4)2molH2O的摩尔质量是1molH2O的摩尔质量的2倍(×)错因:物质的摩尔质量与物质的量的多少无关。(5)1molO2的质量与它的相对分子质量相等(×)错因:1mol物质的质量以g为单位时,在数值上等于其相对分子质量。物质的量、质量和微粒数之间的计算(1)含6.02×1023个中子的Li的质量是_____g。(2)4gD2和20g18O2的单质化合时最多能生成_____gDO。(3)若12.4gNa2X中含有0.4mol钠离子,Na2X的摩尔质量是_________,X的相对原子质量是_______。(4)0.5molH2SO4分子中氢原子数目为个__________个,氧原子数目为__________个。(5)含有1.806×1024个电子的OH-的物质的量为;0.5molH2O分子中所含质子数与________________个NH3中所含质子数相等。(6)一个NO分子的质量是ag,一个NO2分子的质量是bg,设NA是阿伏加德罗常数的值,则氧元素的摩尔质量是_________________。答案:(1)(2)22(3)62g·mol-116(4)6.02×10231.204×1024(5)0.3mol3.01×1023g·mol-1知识点02气体摩尔体积阿伏加德罗定律1.气体摩尔体积(1)概念:一定温度和压强下单位物质的量的气体所占的体积,符号为Vm。(2)常用单位:L/mol(或L·mol-1)。(3)公式:n=V=n·VmVm=(4)标准状况下的气体摩尔体积标准状况下(0℃、101kPa),Vm≈22.4L·mol-1。标准状况是特定条件,不是常温常压,计量对象在该条件下必须为气态。2.阿伏加德罗定律及其推论(1)阿伏加德罗定律内容在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。(2)阿伏加德罗定律的推论公式语言叙述(背会)T、p相同=同温、同压下,气体的体积与其物质的量成正比=同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成正比T、V相同=温度、体积相同的气体,其压强与其物质的量成正比小学、初中、高中各种试卷真题知...