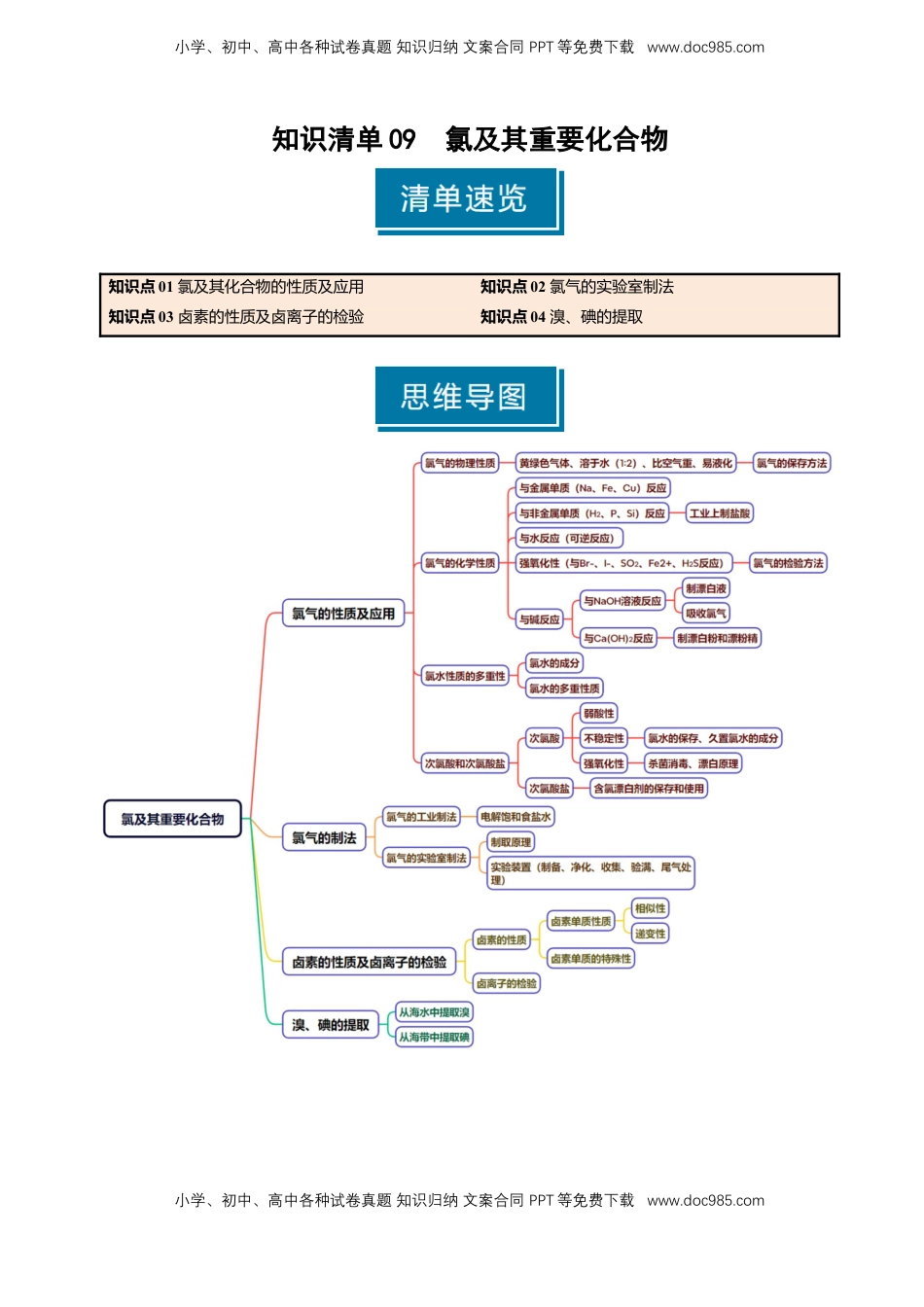
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单09氯及其重要化合物知识点01氯及其化合物的性质及应用知识点02氯气的实验室制法知识点03卤素的性质及卤离子的检验知识点04溴、碘的提取小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01氯及其化合物的性质及应用一、氯气的性质1.氯气的物理性质氯气是一种黄绿色、有刺激性气味的气体,密度比空气大,可溶于水(1:2),易液化,有毒。工业上通常将氯气液化后保存在钢瓶里。实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。2.氯气的化学性质(1)氧化性①与金属单质反应:与铁反应:2Fe+3Cl2=====2FeCl3,实验现象:生成棕色烟。与铜反应:Cu+Cl2=====CuCl2,实验现象:生成棕黄色烟。②与非金属单质反应:a.与H2反应:H2+Cl2=====CuCl2,实验现象:有苍白色火焰,出现白雾。应用:工业上制盐酸。H2与Cl2的混合物点燃或光照发生爆炸。b.能将P氧化为PCl3、PCl5,与Si反应生成SiCl4。③与还原性物质反应:与KI溶液反应:Cl2+2KI===2KCl+I2,实验室用湿润的淀粉碘化钾试纸检验Cl2。与SO2水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl。与FeCl2溶液反应:Cl2+2FeCl2===2FeCl3。(2)Cl2与水和碱反应——歧化反应a.与水反应:Cl2+H2OHCl+HClO(可逆反应)b.与NaOH溶液反应:Cl2+2NaOH===NaCl+NaClO+H2O。应用:实验室用NaOH溶液吸收多余的氯气,工业上制取消毒液。c.与石灰乳反应制取漂白粉:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2,漂粉精的主要成分是Ca(ClO)2。3.氯水的成分和性质氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。(1)氯水中存在三种平衡关系:①Cl2+H2OHCl+HClO②HClOH++ClO-③H2OH++OH-氯水中存在的微粒:小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(2)氯水性质的多重性新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。注:氯水常代替氯气进行溶液中的实验。(4)液氯、新制氯水、久置氯水的比较液氯新制氯水久置氯水类别(纯净物或混合物)纯净物混合物混合物微粒Cl2H2O、Cl2、HClO、ClO-、Cl-、H+、OH-H2O、Cl-、H+、OH-颜色黄绿色淡黄绿色无色性质氧化性酸性、氧化性酸性二、次氯酸和次氯酸盐的性质1.次氯酸(1)弱酸性:酸性比碳酸弱(2)不稳定性:2HClO=====2HCl+O2↑,久置氯水的成分是稀盐酸。氯水要现用现配,保存在棕色试剂瓶中。(3)强氧化性:使有色布条褪色,具有漂白作用和杀菌消毒作用。2.次氯酸的漂白原理、特点及应用范围(1)原理:将有色有机物质氧化为稳定的无色物质。(2)特点:被HClO漂白后的物质,久置后不再恢复原色,即HClO的漂白具有不可逆性。(3)应用范围:几乎所有有色有机物质遇HClO都会褪色。3.含氯消毒剂的合理使用(1)漂白粉应密封、避光保存,并置于阴凉干燥处。(2)含氯漂白剂与洁厕剂(含有盐酸)不能混合使用,因为两者混合会反应生成氯气。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(3)新型灭菌消毒剂——二氧化氯:杀菌、消毒能力比氯气强。(1)发生氯气泄漏时,污染区的居民应向低洼处转移(×)错因:氯气密度比空气大,应向高处转移。(2)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液(×)错因:CuCl2溶液呈蓝绿色。(3)Cl2与H2O反应生成HCl和HClO,故氯水中无Cl2分子(×)错因:Cl2与H2O的反应是可逆反应,故氯水中有Cl2分子。(4)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是电解质(×)错因:电解质必须是化合物,Cl2是单质...