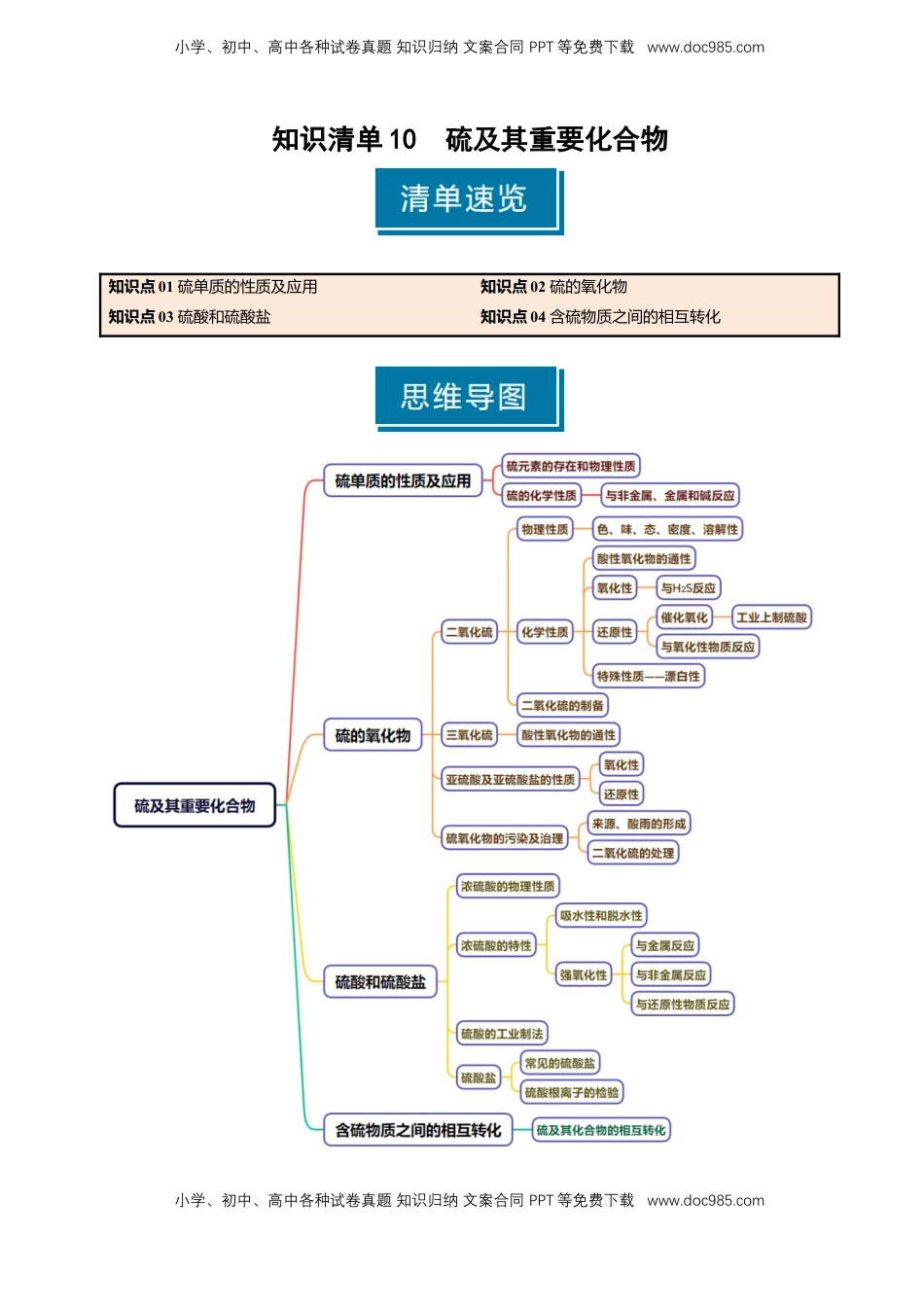
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单10硫及其重要化合物知识点01硫单质的性质及应用知识点02硫的氧化物知识点03硫酸和硫酸盐知识点04含硫物质之间的相互转化小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01硫单质的性质及应用1.硫元素的存在形态游离态:火山口附近或地壳的岩层里;化合态:主要以硫化物和硫酸盐的性质存在。2.硫的物理性质黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS2。3.硫的化学性质S←――――――→S(1)与非金属单质反应与氧气反应:S+O2=====SO2与氢气反应:S+H2=====H2S(2)与金属反应与钠反应:2Na+S===Na2S与铁反应:Fe+S=====FeS与铜反应:2Cu+S=====Cu2S与汞反应:Hg+S===HgS应用:去除洒落的汞硫与变价金属反应生成低价态化合物(3)与NaOH溶液反应:3S+6NaOH=====2Na2S+Na2SO3+3H2O应用:清洗试管壁残留的硫(1)硫与Fe反应生成FeS,与Cu反应生成CuS(×)错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)2。(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√)(3)硫与少量的O2反应生成SO2,与过量的O2反应生成SO3(×)错因:硫燃烧只能生成SO2,与O2的量无关,SO2与O2反应生成SO3,需要温度较高,且有催化剂存在才可以。(4)硫与少量的O2反应生成SO2,与过量的O2反应生成SO3(×)错因:硫燃烧只能生成SO2,与O2的量无关,SO2与O2反应生成SO3,需要温度较高,且有催化剂存在才可以。(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗(×)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com错因:硫微溶于酒精,易溶于CS2,残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶液除去。1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl2与变价金属反应生成高价态化合物,S与变价金属反应生成低价态化合物;(2)氢化物的稳定性:HCl>H2S;(3)置换反应:H2S+Cl2===2HCl+S↓;(4)最高价含氧酸的酸性:HClO4>H2SO4;(5)还原性:S2->Cl-。2.S与NaOH溶液反应的方程式为:3S+6NaOH=====2Na2S+Na2SO3+3H2O,氧化剂与还原剂的物质的量之比为2:1,每1molS参加反应,转移的电子数为4NA。知识点02硫的氧化物一、二氧化硫(SO2)1.物理性质色、态、味密度溶解性毒性无色有刺激性气味的气体比空气大易溶于水,通常状况下,1体积水溶解约40体积SO2有毒2.化学性质(1)酸性氧化物的通性①与水反应:SO2+H2OH2SO3,H2SO3是中强酸,水溶液能使紫色石蕊试液变红色,但不能漂白石蕊试液。②二氧化硫能与碱、碱性氧化物等反应。与NaOH溶液反应:SO2+2NaOH===Na2SO3+H2O应用:用NaOH溶液吸收SO2气体与澄清石灰水反应:SO2+Ca(OH)2===CaSO3↓+H2O与CaO反应:SO2+CaO===CaSO3③Na2SO3溶液中通入SO2气体:Na2SO3+SO2+H2O===2NaHSO3(2)氧化性(如与H2S反应):SO2+2H2S===3S+2H2O小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(3)还原性①催化氧化:2SO2+O22SO3(可逆反应)应用:工业上制取硫酸②在溶液中,SO2、H2SO3、SO与氧化性物质(如Cl2、Br2、I2、O2、H2O2、Fe3+、酸性KMnO4、硝酸等)反应,产物是SO。SO2与氯水反应:SO2+Cl2+2H2O===H2SO4+2HClSO2与H2O2反应:SO2+H2O2===H2SO4H2SO3被氧气氧化:2H2SO3+O2===2H2SO4Na2SO3被氧气氧化:2Na2SO3+O2===2Na2SO4SO2与Fe3+反应:SO2+2Fe3++2H2O===SO+2Fe2++4H+SO与酸性高锰酸钾溶液反应:5SO32-+2MnO+6H+===5SO+2Mn2++3H2O(4)漂白性使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。应用:实验室常用品红溶液检验SO2气体。3.亚硫酸的性质(1)弱酸性:H2SO3H++HSO(电离方程...