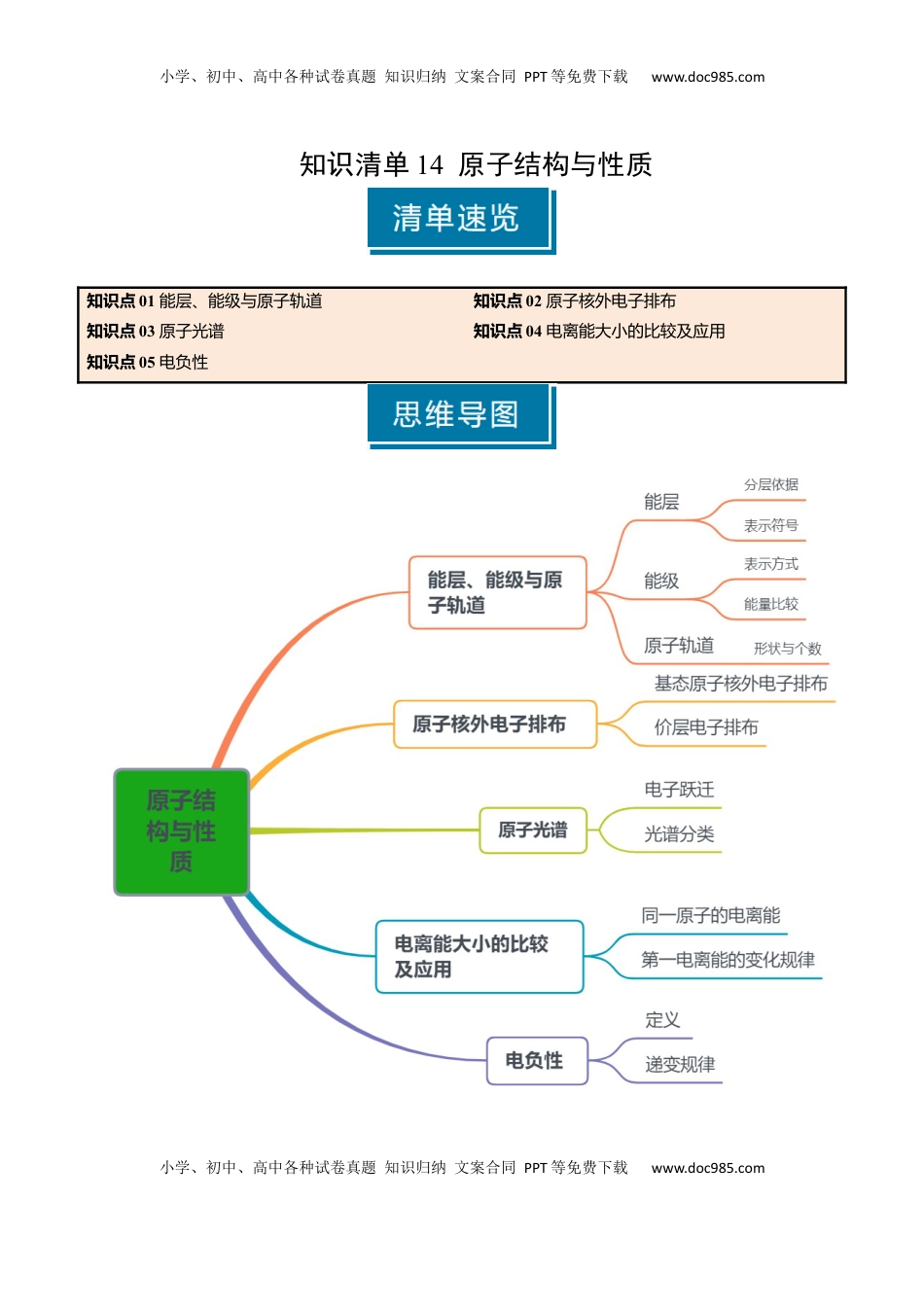
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单14原子结构与性质知识点01能层、能级与原子轨道知识点02原子核外电子排布知识点03原子光谱知识点04电离能大小的比较及应用知识点05电负性小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01能层、能级与原子轨道能层、能级与原子轨道的含义1.能层(n):(又称:电子层)(1)分层依据:按照电子的能量差异(2)表示符号:K、L、M、N、O、P、Q2.能级:在多电子原子中,同一能层里电子的_能量__也可能不同,又将其分成不同的能级,通常用_s、p、d、f__等表示,同一能层里,各能级的能量按_s、p、d、f__的顺序依次升高,即_E(s)<E(p)<E(d)<E(f)__。3.原子轨道:电子云轮廓图给出了电子在_核外常出经现__的区域。这种电子云轮廓图称为原子轨道。(1)原子轨道形状和个数符号spd电子云形状球形纺锤形或哑铃形花瓣形轨道个数135(2)能量关系①相同能层上原子轨道能量的高低:ns<np<nd<nf②形状相同的原子轨道能量的高低:1s<2s<3s<4s......③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如2px、2py、2pz轨道的能量相等④不同能级具有交错现象:ns<(n-2)f<(n-1)d<np4.1~36号元素的能层和能级(1)K层:有1s一个能级(2)L层:有2s、2p两个能级(3)M层:有3s、3p、3d三个能级小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(4)N层:有4s、4p、4d、4f四个能级5.原子核外电子排布的原理(1)能量最低原理:电子尽先排布在能量最低的轨道中。(2)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋方向相反的电子。如:(3)洪特规则:电子在能量相同原子轨道上排布时,应尽可能分占不同的轨道而且自旋方向相同。错误正确N原子的2p轨道(4)洪特规则特例:能量相同的原子轨道在下列情况时,体系能量最低①全满;即s2、p6、d10②半满;即s1、p3、d5③全空;即s0、p0、d06.基态原子核外电子排布的表示方法表示方法举例(以硫原子为例)电子排布式S:_1s22s22p63s23p4__简化电子排布式[Ne]3s23p4电子排布图(轨道表达式)注意空轨道不能省略外围(价层)电子排布式3s23p41.能层、能级与原子轨道易错点(1)能层数=电子层数。(2)第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。(3)要注意比较原子核外电子排布式、简化电子排布式、原子外围电子排布式的区别与联系。如Cu的电子排布式:1s22s22p63s23p63d104s1;简化电子排布式:[Ar]3d104s1;外围价层电子排布式:3d104s1。(4)核外电子排布常见错误①在写基态原子的电子排布图时,常出现以下错误:小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com②当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2,而失电子时,却先失4s轨道上的电子,如Fe3+:1s22s22p63s23p63d5。2.判断正误,正确的打“√”,错误的打“×”。(1)原子核外的电子像云雾一样笼罩在原子核周围,故称为电子云。()(2)p能级能量一定比s能级的能量高。()(3)基态磷原子的电子排布图为()。(4)同一原子中,2p、3p、4p能级的轨道数依次增多。()(5)Cr的电子排布式为1s22s22p63s23p63d44s2。()(6)2p和3p轨道形状均为哑铃状,能量也相等。()(7)2s能级和2p能级所具有的原子轨道数目之比为1∶3。()(8)能量关系:1s<2s<3p<3d<4s。()(9)基态氮原子最外层有2个未成对电子。()(10)1~36号元素中,基态原子未成对电子数最多的是Cr元素。()(11)基态Zn原子的电子排布式为[Ar]4s23d10。()(12)电子排布式(22Ti)1s22s22p63...