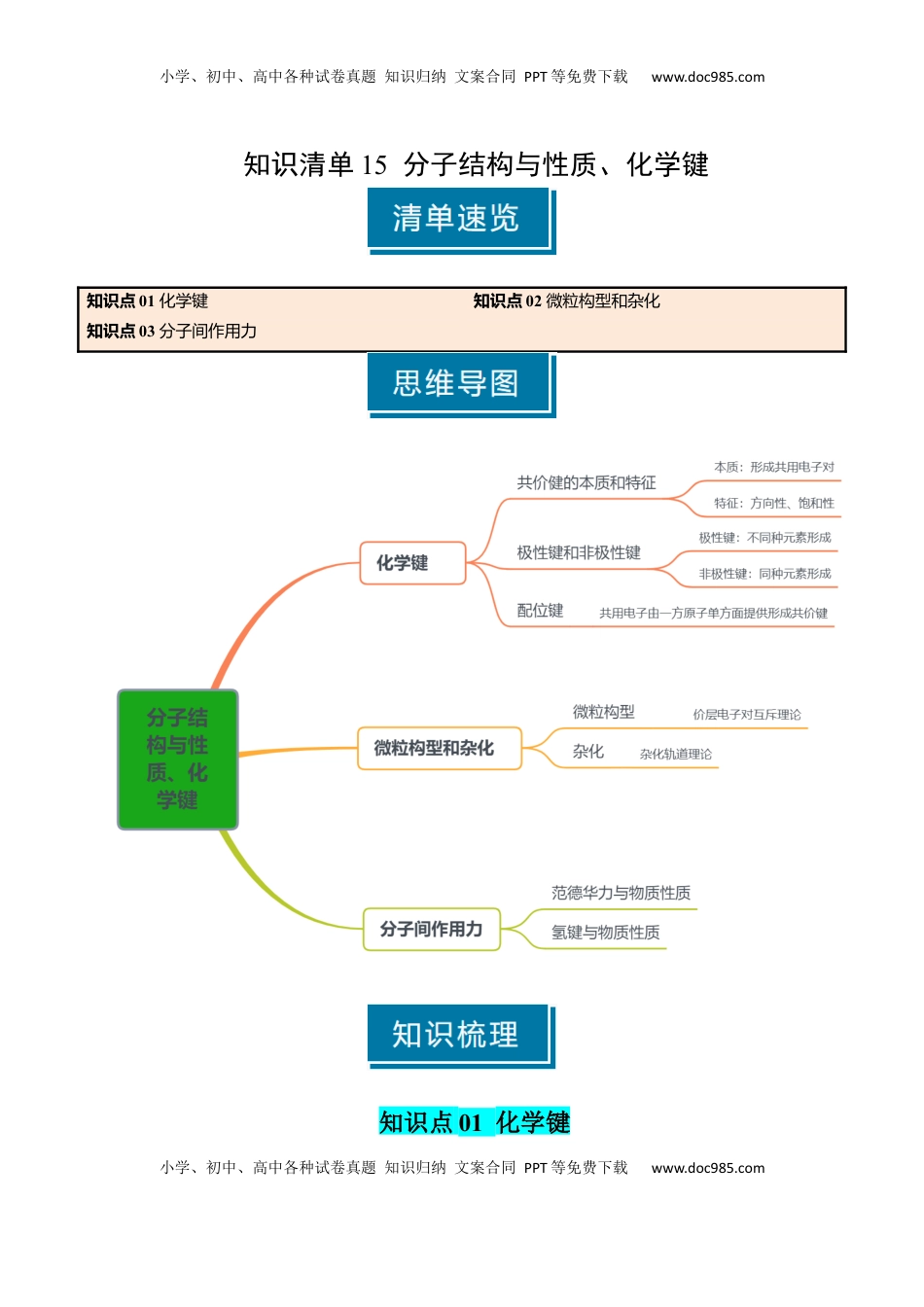
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单15分子结构与性质、化学键知识点01化学键知识点02微粒构型和杂化知识点03分子间作用力知识点01化学键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com一、共价键的特征及成键原则1.共价键的本质和特征共价键本质两原子之间形成共用电子对特征一定有饱和性有方向性(H-H键除外)2.常见原子的成键数目IAIIAIIIAIVAVAVIAVIIAHBeB、AlC、SiN、PO、SF、Cl12343213.形成化学键的目的:使体系的能量最低,达到稳定结构二、极性键和非极性键1.分类依据:共用电子对的偏移程度2.极性键和非极性键的比较分类极性共价键非极性共价键成键原子不同元素原子相同元素原子电子对发生偏移不发生偏移成键原子的电性一个原子呈正电性(δ+),一个原子呈负电性(δ-)呈电中性3.极性强弱:成键元素的电负性差别越大,共用电子对偏移程度越大,极性越强。4.键的极性对化学性质的影响(1)共价键的极性越强,键的活泼性也越强,容易发生断裂,易发生相关的化学反应。(2)成键元素的原子吸引电子能力越强,电负性越大,共价键的极性就越强,在化学反应中该分子的反应活性越强,在化学反应中越容易断裂。5.键的极性对羧酸酸性的影响(1)三氟乙酸与三氯乙酸的酸性强弱①酸性强弱三氟乙酸>三氯乙酸②原因电负性:F>Cl极性:F-C>Cl-C极性:F3C->Cl3C-羟基极性:三氟乙酸>三氯乙酸(2)甲酸、乙酸和丙酸的酸性强弱①酸性强弱:甲酸>乙酸>丙酸②原因烷基(-R)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。随着烷基加长,酸性差异越来越小三、σ键和键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.分类依据:电子云的重叠方式和程度2.形成(1)σ键的形成σ键形成由成键原子的s轨道或p轨道重叠形成类型①s-s型②s-p型③p-p型(2)键的形成:由两个原子的p轨道“肩并肩”重叠形成3.成键特点共价键σ键键电子云重叠方式头碰头平行或肩并肩轨道重叠程度大小电子云对称特征轴对称镜像对称能否自由旋转能不能3.(1)判断方法:一般来说,共价单键是σ键,共价双键是σ+键,共价三键是σ+2键。(2)常见分子中的键型和数目分子N2HCNCOSC2H4C2H2结构式H—C三NO=C=SH-C三C-H小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com键型、数目1个σ键2个键2个σ键2个键2个σ键2个键5个σ键1个键3个σ键2个键4.稳定性:一般σ键稳定,必须根据键能进行计算化学键N≡NN-N键能kJ·mol-1942247计算判断氮气中键的稳定。四、配位键1.配位键配位键概念共用电子由一方原子单方面提供形成共价键本质一类特殊的共价键①配位键一旦形成,与普通的共价键没有任何区别②配位键都是σ键(从电子云重叠角度考虑)成键条件①中心体提供空轨道的原子、分子或离②配位体提供孤对电子的原子、分子或离子特征①有方向性孤对电子必须沿着“空轨道”的方向来成键②有饱和性“空轨道”和孤对电子都是有限的2.配位键的判断及表示(1)配位键的判断①不正常的共价键即为配位键(比正常的成键数多或少)②分子和其他微粒形成的化学键一定是配位键(2)表示方法:A(配位体)→B(中心体)①金属和非金属间成键:非金属元素→金属元素②非金属和非金属成键:需判断孤对电子提供者(3)离子中的配位键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com五、配合物(络合物)1.概念:金属离子或原子与某些微粒以配位键结合形成的化合物(1)配合物中的两个“一定”①配位化合物中一定含有配位键②一定含有...