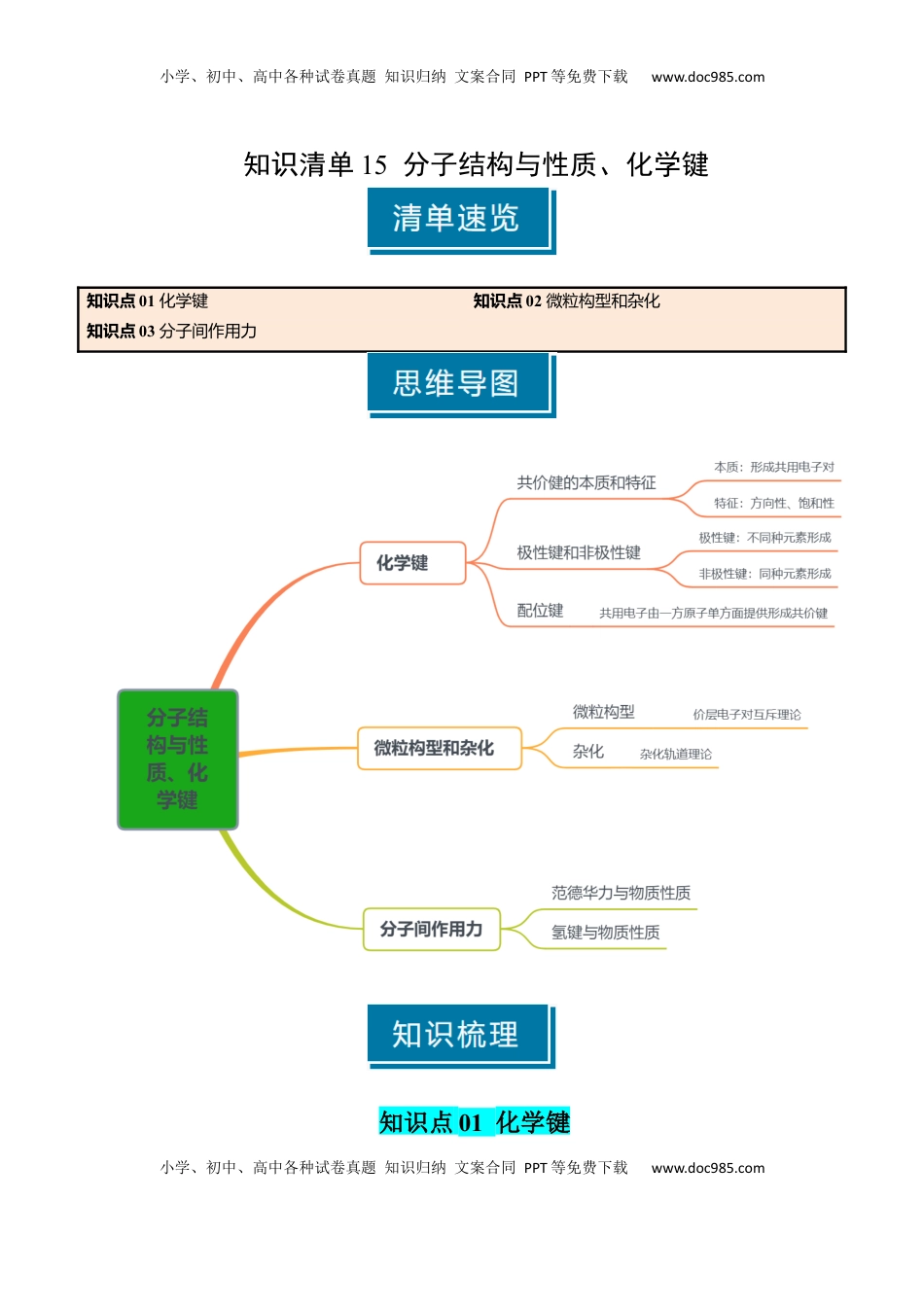
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单15分子结构与性质、化学键知识点01化学键知识点02微粒构型和杂化知识点03分子间作用力知识点01化学键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com一、共价键的特征及成键原则1.共价键的本质和特征共价键本质两原子之间形成共用电子对特征一定有饱和性有方向性(键除外)2.常见原子的成键数目IAIIAIIIAIVAVAVIAVIIAHBeB、AlC、SiN、PO、SF、Cl3.形成化学键的目的:使体系的能量最,达到稳定结构二、极性键和非极性键1.分类依据:2.极性键和非极性键的比较分类极性共价键非极性共价键成键原子元素原子元素原子电子对偏移偏移成键原子的电性一个原子呈电性(δ+),一个原子呈电性(δ-)呈3.极性强弱:成键元素的电负性越大,共用电子对偏移程度越大,极性越。4.键的极性对化学性质的影响(1)共价键的极性越强,键的活泼性也越,发生断裂,发生相关的化学反应。(2)成键元素的原子吸引电子能力越强,电负性越,共价键的极性就越,在化学反应中该分子的反应活性越,在化学反应中越断裂。5.键的极性对羧酸酸性的影响(1)三氟乙酸与三氯乙酸的酸性强弱①酸性强弱三氟乙酸三氯乙酸②原因电负性:FCl极性:F-CCl-C极性:F3C-Cl3C-羟基极性:三氟乙酸三氯乙酸(2)甲酸、乙酸和丙酸的酸性强弱①酸性强弱:甲酸乙酸丙酸②原因烷基(-R)是基团,烷基越长效应越大,使羧基中的羟基极性,羧酸的酸性。随着烷基加长,酸性差异越来越三、σ键和键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.分类依据:2.形成(1)σ键的形成σ键形成由成键原子的s轨道或p轨道重叠形成类型①s-s型②s-p型③p-p型(2)键的形成:由两个原子的p轨道“肩并肩”重叠形成3.成键特点共价键σ键键电子云重叠方式或轨道重叠程度电子云对称特征对称对称能否自由旋转3.(1)判断方法:一般来说,共价单键是键,共价双键是键,共价三键是键。(2)常见分子中的键型和数目分子N2HCNCOSC2H4C2H2结构式H—C三NO=C=SH-C三C-H键型、数目个σ键个σ键个σ键个σ键个σ键小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com个键个键个键个键个键4.稳定性:一般键稳定,必须根据键能进行计算化学键N≡NN-N键能kJ·mol-1942247计算判断氮气中键的稳定。四、配位键1.配位键配位键概念共用电子由提供形成共价键本质一类特殊的②配位键一旦形成,与普通的共价键没有任何区别②配位键都是键(从电子云重叠角度考虑)成键条件提供空轨道的原子、分子或离提供孤对电子的原子、分子或离子特征性孤对电子必须沿着“空轨道”的方向来成键性“空轨道”和孤对电子都是有限的2.配位键的判断及表示(1)配位键的判断①不正常的共价键即为配位键(比正常的成键数多或少)②分子和其他微粒形成的化学键一定是配位键(2)表示方法:A(配位体)→B(中心体)①金属和非金属间成键:元素→元素②非金属和非金属成键:需判断孤对电子提供者(3)离子中的配位键五、配合物(络合物)1.概念:或与某些微粒以配位键结合形成的化合物小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)配合物中的两个“一定”①配位化合物中一定含有配位键②一定含有金属原子或离子,即中心体(2)含配位键的化合物不一定是配合物,如NH4+、H3O+等(3)配离子:中心体与配位体通过配位键结合形成的复杂离子2.配合物的构成(1)几个概念①中心原子或离子:即中心体,提供,一般只有1个②配体:即配位体,提供,可能有多个③配位数:直接同中心离子(或原子)配...