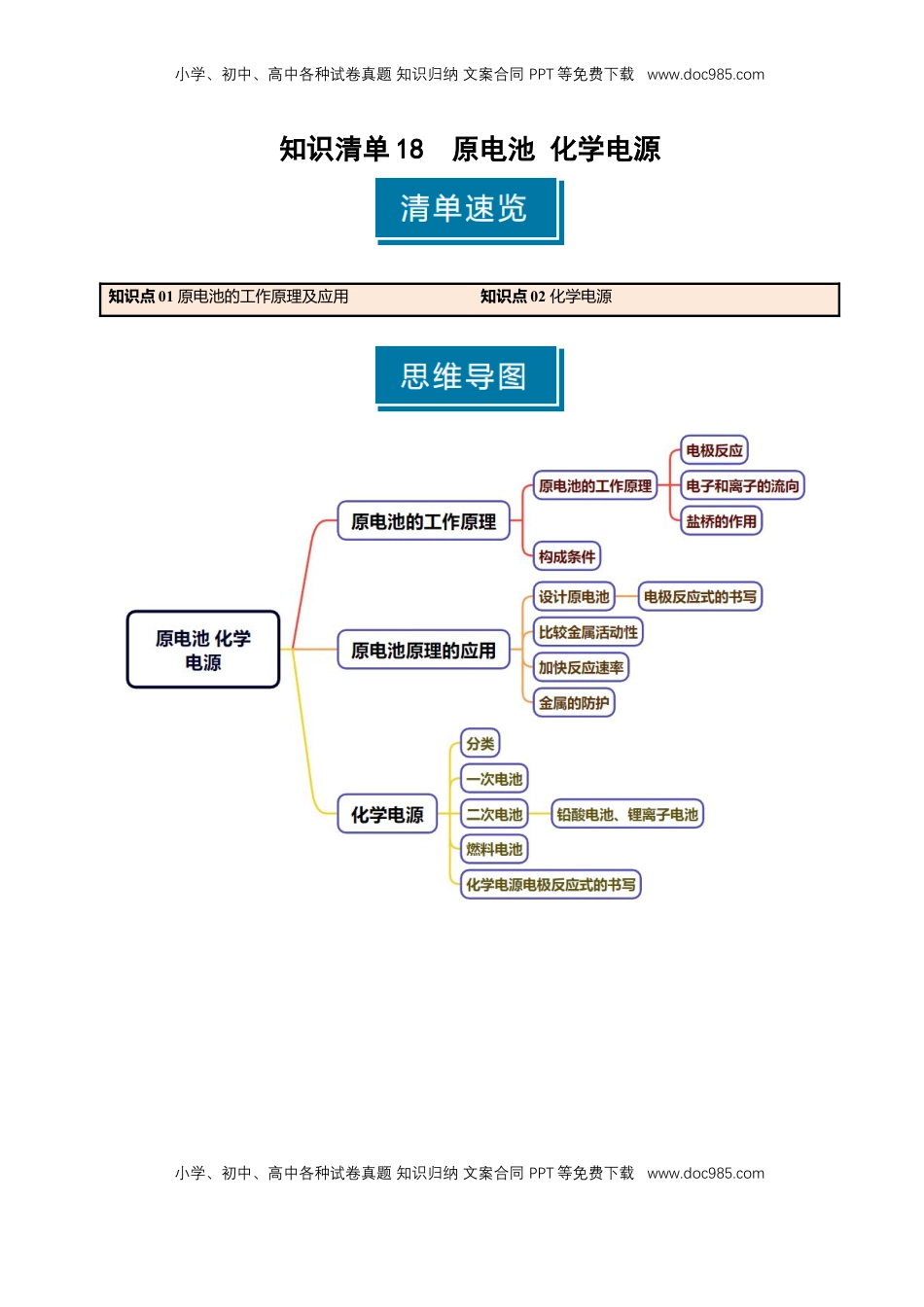
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单18原电池化学电源知识点01原电池的工作原理及应用知识点02化学电源小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01原电池的工作原理及应用1.原电池的概念和实质(1)概念:将化学能转化为电能的装置。(2)实质:利用能自发进行的氧化还原反应把化学能转化为电能。2.原电池的工作原理(1)电极反应:负极:失去电子,发生氧化反应正极:得到电子,发生还原反应(2)电子移动方向:从负极流出沿导线流入正极,电子不能通过电解质溶液。(3)离子移动方向:①阴离子向负极移动,阳离子向正极移动。②如果有盐桥:盐桥中的阴离子移向负极区,阳离子移向正极区。(4)盐桥的作用:①离子通道,形成闭合回路。②避免电极与电解质溶液直接反应,减少电流的衰减。3.原电池的构成条件①形成闭合回路;②两个活性不同的电极,相对较活泼的金属作负极;③电解质溶液或熔融电解质;④自发的氧化还原反应(一般能对外界释放能量)。【易错提醒】(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。两极材料可能参与反应,也可能不参与反应。(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。(3)在判断原电池正负极时,既要考虑金属活泼性的强弱,也要考虑电解质溶液性质。如Mg-Al-HCl溶液构成的原电池中,负极为Mg;但是Mg-Al-NaOH溶液构成的原电池中,负极为Al,正极为Mg。4.原电池原理的应用(1)设计制作化学电源①用双线桥分析氧化还原反应的电子转移方向和数目;小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com②分别写出正、负极的电极反应式(半反应式);③根据电极反应式确定半电池的电极材料和电解质溶液:a.电极材料:一般活泼金属作负极,不活泼金属(或非金属导体)作正极;b.电解质溶液:负极电解液一般是负极金属对应的阳离子的溶液;正极电解液一般是氧化剂对应的电解质溶液。(2)比较金属的活动性强弱一般来说,作负极的金属的活动性强于正极金属。如:有两种金属a和b,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生。由此可判断出a是负极、b是正极,且金属活动性:a>b。(3)加快化学反应速率氧化还原反应形成原电池时,反应速率加快。在锌与稀H2SO4反应时加入少量CuSO4溶液,CuSO4与锌发生置换反应生成Cu,从而形成Cu-Zn微小原电池,加快产生H2的速率。(4)用于金属的防护:将需要保护的金属制品作原电池的正极而受到保护。(1)NaOH溶液与稀硫酸的反应是自发进行的放热反应,此反应可以设计成原电池(×)错因:该反应不是氧化还原反应,没有电子转移。(2)Mg—Al形成的原电池,Mg一定作负极(×)错因:若是酸性介质Mg作负极,若是碱性介质Al作负极。(3)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长(√)(4)原电池工作时,电子从负极流出经导线流入正极,然后通过溶液流回负极(×)错因:电子不进入溶液,溶液中阴阳离子定向移动形成电流。(5)在Cu|CuSO4|Zn原电池中,正电荷定向移动的方向就是电流的方向,所以Cu2+向负极移动(×)错因:在外电路中电流由正极流向负极,而在电解质溶液中,阳离子都由负极移向正极。(6)构成原电池两极的电极材料一定是活泼性不同的金属(×)错因:原电池的电极材料必须能导电,不一定是金属,也可以是石墨,燃料电池中两个电极都可以是石墨。(7)原电池中负极失去电子的总数一定等于正极得到电子的总数(√)(8)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路(√)一、原电池的工作原理1.(1)由组成原电池的电极材料判断。一般是活动性较强的金属为极,活动性较弱的金属或能导电的非金属为极。...