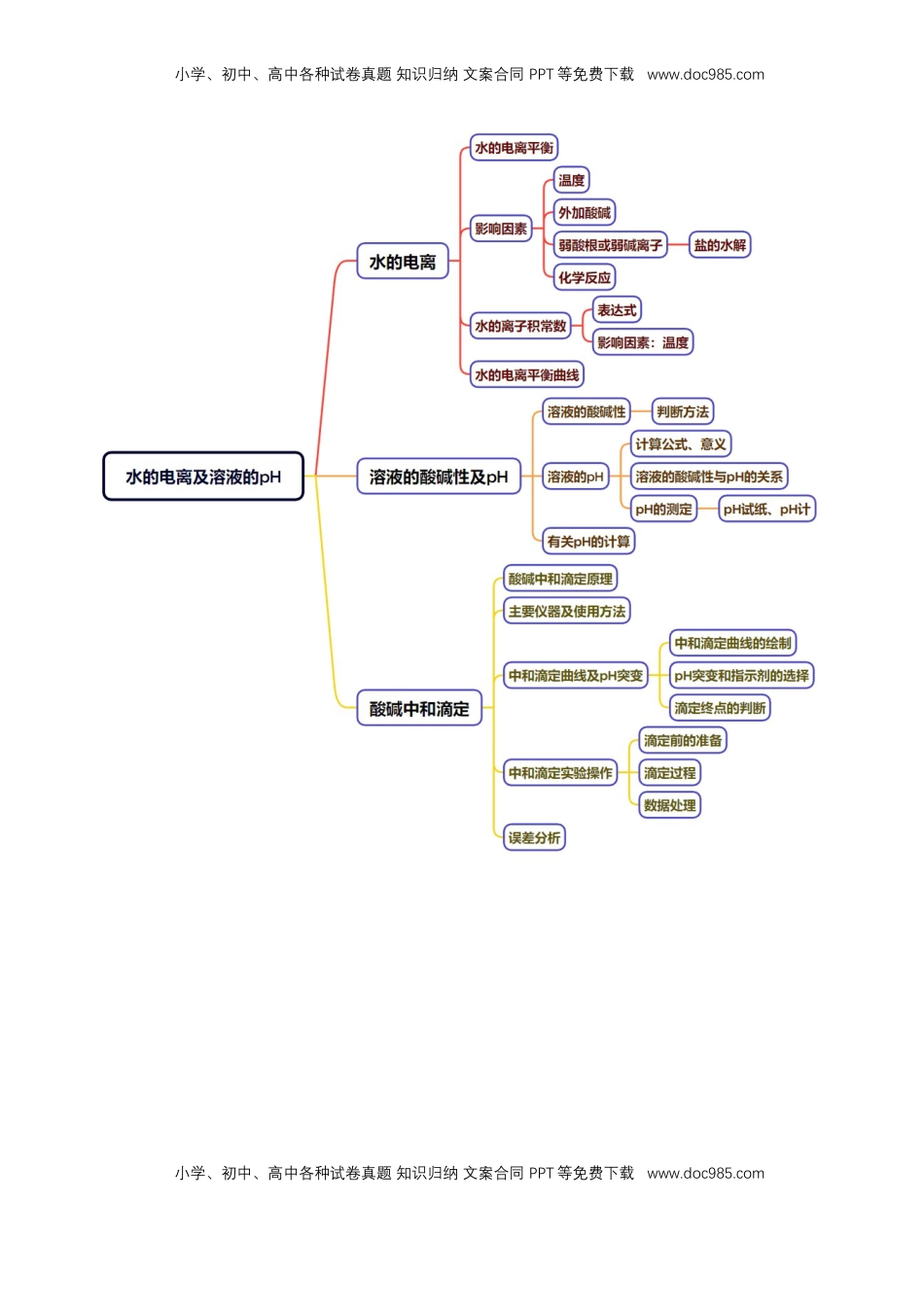
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单22水的电离及溶液的pH知识点01水的电离及离子积常数知识点02溶液的酸碱性及pH知识点03酸碱中和滴定小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01水的电离及离子积常数1.水的电离(1)水是极弱的电解质,其电离方程式为H2O+H2OH3O++OH-,简写为H2OH++OH-。(2)水的电离是吸热过程。2.水的离子积常数(1)Kw只与温度有关,温度升高,Kw增大。(2)常温时,Kw=c(H+)·c(OH-)=1.0×10-14,不仅适用于纯水,还适用于酸、碱的稀溶液。(3)不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)总是相等的。3.水的电离平衡的影响因素(1)因水的电离是吸热过程,故温度升高,会促进水的电离,c(H+)、c(OH-)都增大,水仍呈中性。(2)外加酸(或碱),水中c(H+)[或c(OH-)]增大,会抑制水的电离,水的电离程度减小,Kw不变。(3)加入了活泼金属,可与水电离产生的H+直接发生置换反应,产生H2,使水的电离平衡向右移动。改变条件平衡移动方向c(H+)c(OH-)水的电离程度Kw升高温度右移增大增大增大增大加入HCl(g)左移增大减小减小不变加入NaOH(s)左移减小增大减小不变加入活泼金属(如Na)右移减小增大增大不变加入NaHSO4(s)左移增大减小减小不变【特别提示】(1)在水中加入酸或碱,会抑制水的电离,水电离出的c(H+)、c(OH-)均减小,但仍然相等。在常温下,若由水电离出的c(H+)<1×10-7mol·L-1,该溶液可能显酸性,也可能显碱性。(2)水受热温度升高,促进水的电离,水电离出的c(H+)、c(OH-)均增大,但仍然呈中性。(3)在酸或碱的溶液中,Kw表达式中的c(H+)、c(OH-)均为溶液中两种离子的总浓度,不一定是水电离出的c(H+)、c(OH-)。如0.1mol·L-1盐酸中,c(H+)约为0.1mol·L-1。(1)升高温度,水的电离程度增大,c(H+)和Kw也增大。(√)(2)25℃时,向纯水中通入一定量SO2,水的电离平衡不移动,Kw不变。(×)(3)室温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHSO4溶液中水的电离程度、Kw均相同。(×)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(4)25℃时,1.0mol·L-1NaOH溶液和1.0mol·L-1盐酸中水的电离程度相等。(√)(5)室温下,CH3COONH4和Na2SO4溶液均呈中性,则两溶液中水的电离程度相同。(×)(6)在表达式Kw=c(H+)·c(OH-)中c(H+)、c(OH-)一定是水电离出的。(×)(7)加水稀释醋酸溶液,溶液中所有离子浓度都减小。(×)错因醋酸加水稀释后,H+浓度减小,由于温度不变Kw不变,OH-浓度增大。(8)25℃时CH3COONa溶液的Kw大于100℃时NaOH溶液的Kw。(×)错因Kw只与温度有关,温度越高Kw越大。(9)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。(√)提示不管温度变化还是加入促进或抑制水的电离的物质,水自身电离出的c(H+)和c(OH-)相等。(10)某温度下,纯水中c(H+)=2.0×10-7mol·L-1,则此时c(OH-)=5×10-8mol·L-1。(×)错因纯水中c(H+)=c(OH-)=2×10-7mol·L-1。(11)水的离子积常数的数值大小与温度和稀水溶液的浓度有关。(×)(12)温度一定时,水的电离常数与水的离子积常数相等。(×)(13)100℃的纯水中c(H+)=1×10-6mol·L-1,此时水呈酸性。(×)(14)将水加热,Kw增大,pH减小。(√)(15)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大。(×)一、水的离子积常数及水的电离平衡曲线1.某温度下纯水的c(H+)=2×10-7mol·L-1,则此时c(OH-)为2×10-7m...