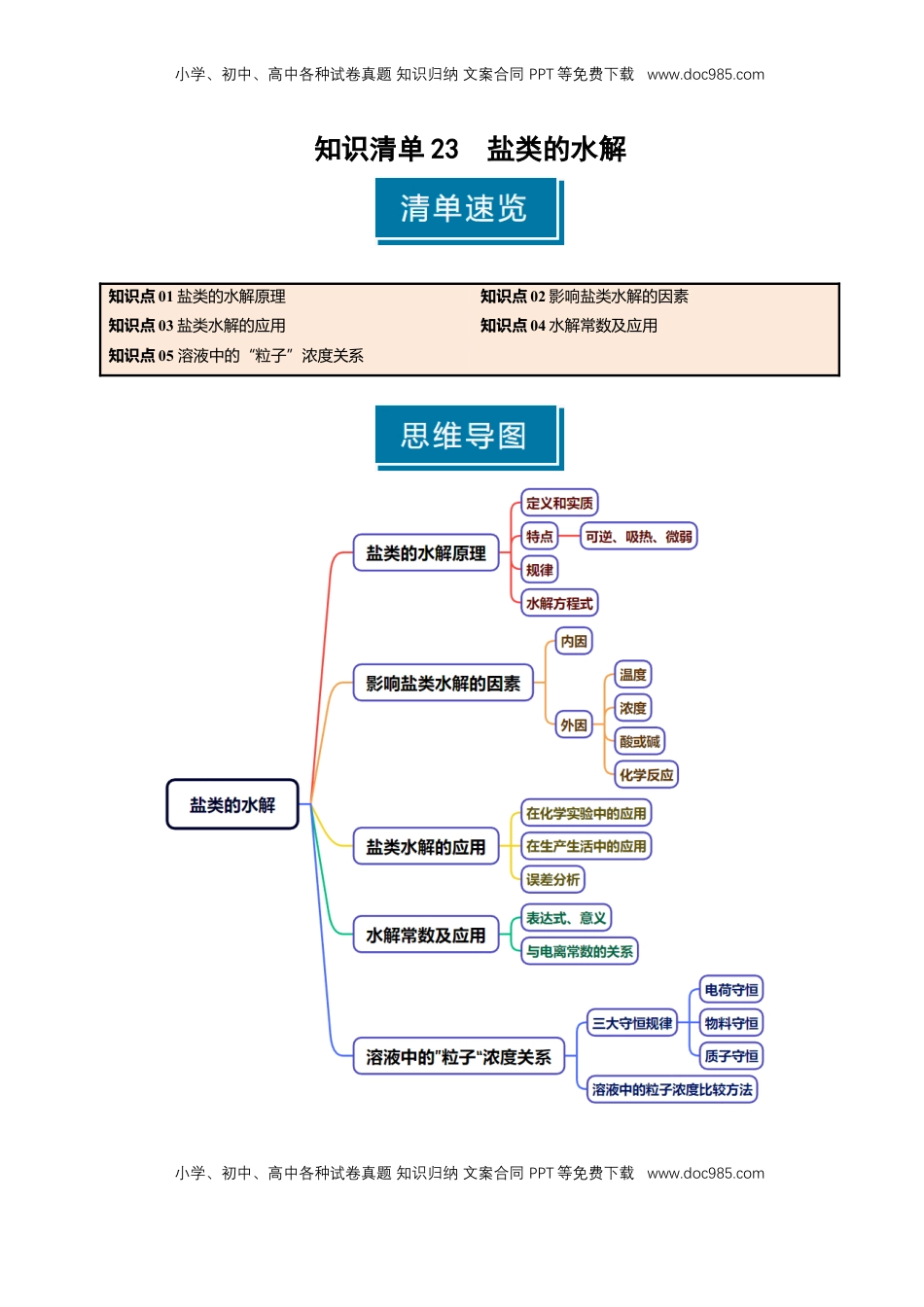
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单23盐类的水解知识点01盐类的水解原理知识点02影响盐类水解的因素知识点03盐类水解的应用知识点04水解常数及应用知识点05溶液中的“粒子”浓度关系小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01盐类的水解原理1.盐类的水解原理(1)定义:在水溶液中盐电离出来的离子与_________________________结合生成____________的反应。(2)条件:可溶性盐中必须存在______________或______________。(3)实质:盐电离产生的______________或______________结合_____________________生成_______,破坏了水的______________,水的电离程度_______。2.盐类水解的特点(1)可逆:盐类的水解是可逆反应。(2)吸热:盐类的水解可看作是______________反应的逆反应。(3)微弱:多数水解反应程度很微弱。3.盐类水解的规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。盐的类型实例是否水解水解的离子溶液的酸碱性强酸强碱盐NaCl、NaNO3强酸弱碱盐NH4Cl、Cu(NO3)2强碱弱酸盐CH3COONa、Na2CO3【特别提醒】(1)温度越高,盐的水解程度越大。(2)强酸的酸式盐只电离,不水解,溶液显酸性。如NaHSO4在水溶液中:NaHSO4===Na++H++SO。(3)判断盐溶液的酸碱性,需先判断盐的类型,因此需熟练记忆常见的强酸、强碱和弱酸、弱碱。(4)盐溶液呈中性,无法判断该盐是否水解。例如:NaCl溶液呈中性,是因为NaCl是强酸强碱盐,不水解。又如CH3COONH4溶液呈中性,是因为CH3COO-和NH的水解程度相当。4.水解反应的离子方程式的书写(1)盐类水解的离子方程式一般用“_______”连接,且一般不标“↑”“↓”等状态符号。(2)多元弱酸盐:分步书写,以第一步为主。(3)多元弱碱盐:水解反应的离子方程式一步完成。(4)阴、阳离子相互促进的水解①若水解程度不大,用“”表示。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com②相互促进的水解程度较大的,书写时用“===”“↑”“↓”。(1)盐类加入水中,水的电离平衡一定被促进。()(2)显酸性的盐溶液,一定是该盐的阳离子发生了水解。()(3)Na2S水解的离子方程式为S2-+2H2OH2S+2OH-。(×)(4)盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱。()(5)Na2CO3溶液呈碱性的原因:CO+2H2OH2CO3+2OH-。()(6)Al3+发生水解反应的离子方程式:Al3++3H2OAl(OH)3↓+3H+。()(7)溶液呈中性的盐一定是强酸、强碱生成的盐。()(8)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同。()(9)熔融的Na2CO3和Na2CO3溶液中,c(Na+)都是c(CO)的两倍。()(10)由0.1mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2OHA+OH-。()一、盐类水解的实质及规律1.根据相关物质的电离常数(25℃),回答下列问题:CH3COOHKa=1.8×10-5,HCNKa=4.9×10-10,H2CO3Ka1=4.3×10-7Ka2=5.6×10-11(1)相同物质的量浓度的①CH3COONa、②Na2CO3、③NaHCO3、④NaCN溶液,pH由大到小的顺序:_____________________,水的电离程度由大到小的顺序:_____________________。(2)相同pH的①CH3COONa,②Na2CO3,③NaHCO3,④NaCN溶液,物质的量浓度由大到小的顺序:_____________________。(3)NaCN溶液中,c(Na+)、c(CN-)、c(HCN)由大到小的顺序:_____________________。2.碳酸氢钠在分析化学、无机合成、工业生产、农牧业生产等方面有较为广泛的应用。(1)NaHCO3是强碱弱酸的酸式盐,溶液中存在三种平衡(写出相应的离子方程式):①水的电离平衡:_____________________;②HCO的电离平衡:_____________________;③HCO的水解平衡:_____________________。(2)常温下,0.1mol·L-1NaHCO3溶液的pH为8.4,说明HCO的电离程度和水解程度中相对较强的是______________。(3)...