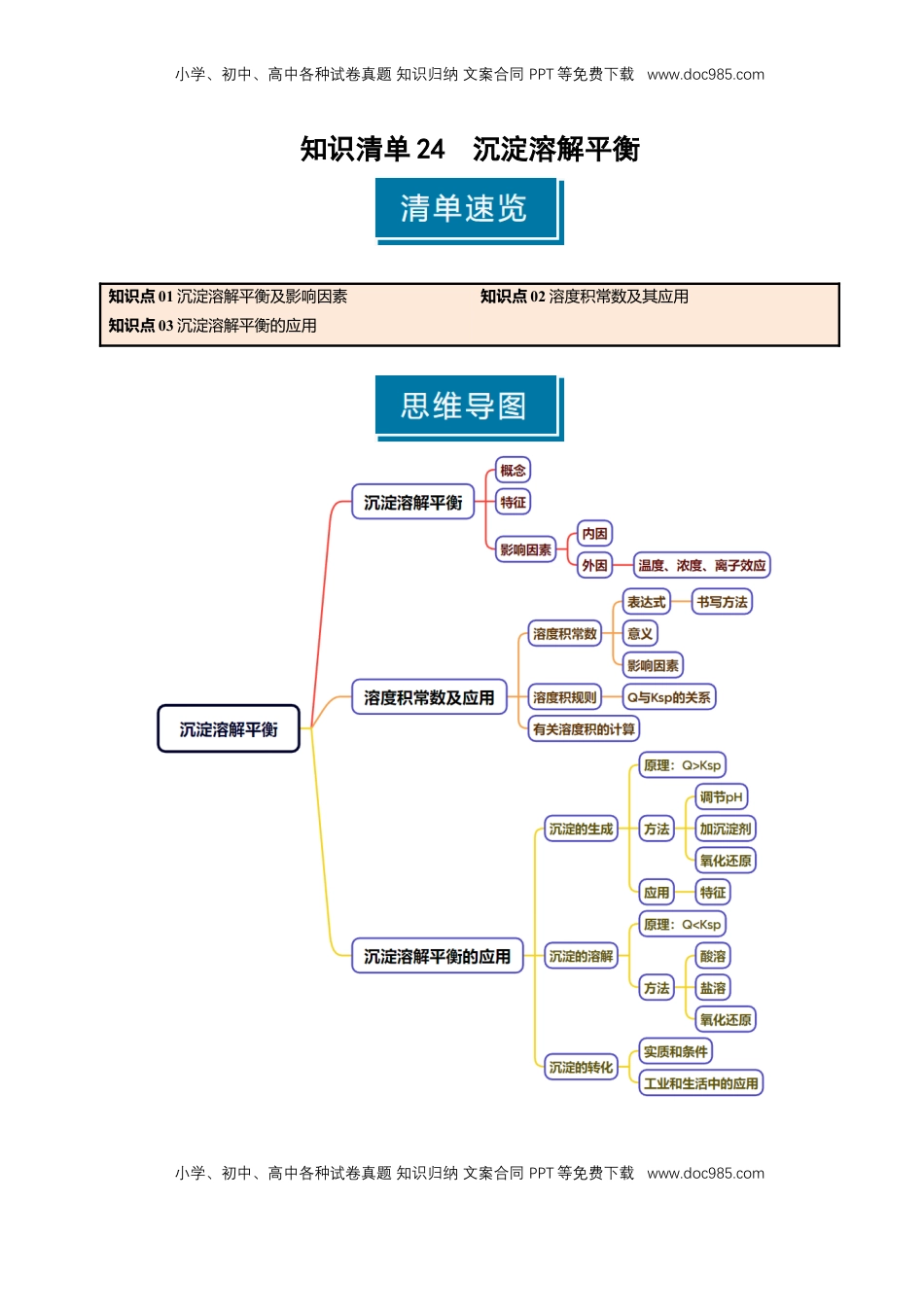
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识清单24沉淀溶解平衡知识点01沉淀溶解平衡及影响因素知识点02溶度积常数及其应用知识点03沉淀溶解平衡的应用小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com知识点01沉淀溶解平衡及影响因素1.25℃时,溶解性与溶解度的关系溶解性易溶可溶微溶难溶溶解度>10g1~10g0.01~1g<0.01g2.难溶电解质的沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当沉淀和溶解的速率相等时,形成电解质的_______溶液,达到平衡状态,人们把这种平衡称为沉淀溶解平衡。(2)沉淀溶解平衡的特征①动态平衡:______________。②达到平衡时,溶液中离子的浓度______________。③当改变外界条件时,溶解平衡将______________,达到新的平衡。3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质______________。(2)外因:温度、浓度等条件的影响符合勒夏特列原理。①温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向_______方向移动。②浓度:加水稀释,平衡向_______方向移动。③离子效应:向平衡体系中加入难溶物相应的离子,平衡_______移动。④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向_______方向移动。(3)实例分析:已知沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):条件改变移动方向c(Mg2+)c(OH-)加少量水升温加MgCl2(s)加盐酸加NaOH(s)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)升高温度,沉淀溶解平衡一定正向移动。()(2)NaCl溶解性很好,饱和NaCl溶液中不存在溶解平衡。()(3)沉淀达到溶解平衡时,溶液中难溶电解质电离出的各个离子浓度均相等。()(4)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。()(5)沉淀溶解是吸热过程,降低温度,溶解平衡一定逆向移动。()(6)Mg(OH)2在NaOH溶液中的溶解度与在水中一样。()(7)BaSO4===Ba2++SO和BaSO4(s)Ba2+(aq)+SO(aq),两式所表示的意义相同。()(8)难溶电解质达到沉淀溶解平衡时,保持温度不变,增加难溶电解质的量,平衡向溶解方向移动。()(1)利用生成沉淀的方法能否全部除去要沉淀的离子?(2)试用平衡移动原理解释下列事实:分别用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,为什么用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量?知识点02溶度积常数及其应用1.概念在一定温度下,难溶电解质达到沉淀溶解平衡后的溶液为_____溶液,其离子浓度____________,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。2.表达式AmBn(s)mAn+(aq)+nBm-(aq)Ksp=______________。如Fe(OH)3的Ksp=______________。3.意义Ksp的大小反映难溶电解质在水中的_______能力。(1)相同类型的难溶电解质,溶度积小的电解质,其溶解能力_______。(2)不同类型的难溶电解质,溶度积小的电解质,其溶解能力_______比溶度积大的溶解能力小。4.影响因素小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com溶度积Ksp值的大小只与难溶电解质本身的性质和_______有关,与浓度无关。5.应用——溶度积规则通过比较溶度积与溶液的离子积Q,如对于Ag2S溶液来说,任意时刻的Q=c2(Ag+)·c(S2-)]的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:(1)Q>Ksp,溶液_______,______________,直至溶液饱和,达到新的平衡。(2)Q=Ksp,溶液_______,沉淀与溶解处于_______状态。(3)Q<Ksp,溶液_______,______________,若加入过量难溶电解质,难溶电解质溶解直至_________...