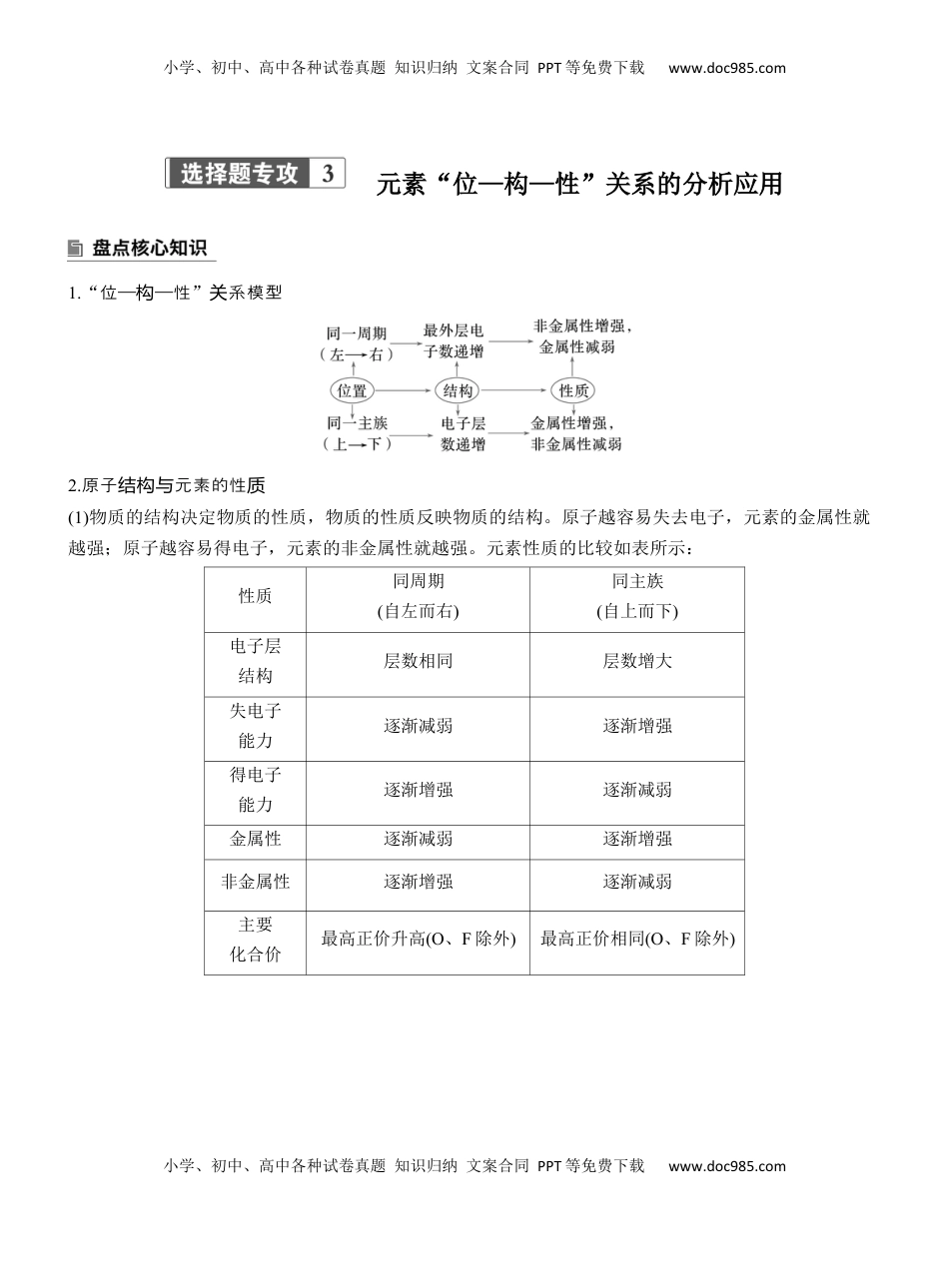
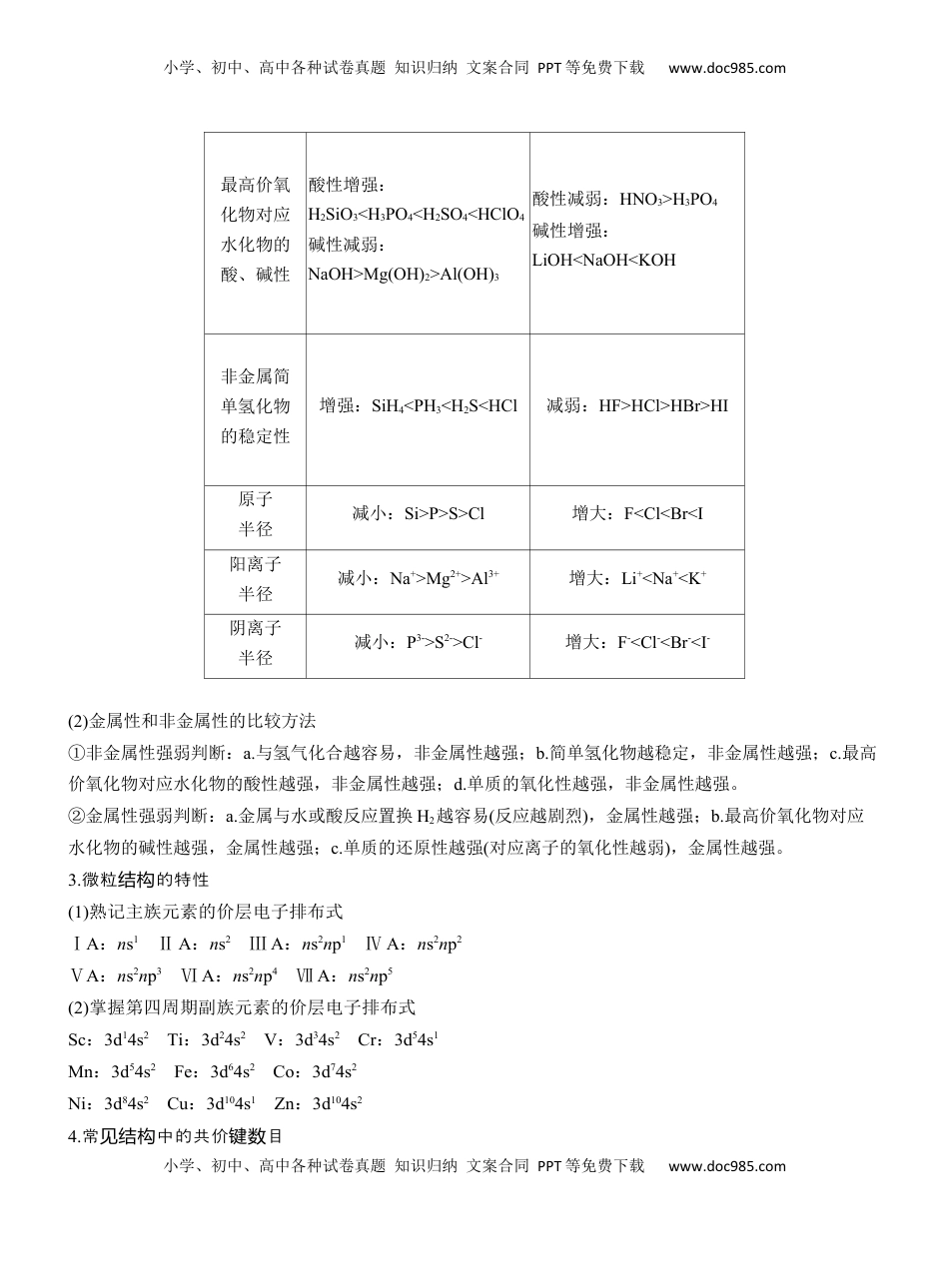
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com元素“位—构—性”关系的分析应用1.“位——性构”系模型关2.原子元素的性结构与质(1)物质的结构决定物质的性质,物质的性质反映物质的结构。原子越容易失去电子,元素的金属性就越强;原子越容易得电子,元素的非金属性就越强。元素性质的比较如表所示:性质同周期(自左而右)同主族(自上而下)电子层结构层数相同层数增大失电子能力逐渐减弱逐渐增强得电子能力逐渐增强逐渐减弱金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱主要化合价最高正价升高(O、F除外)最高正价相同(O、F除外)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com最高价氧化物对应水化物的酸、碱性酸性增强:H2SiO3<H3PO4<H2SO4<HClO4碱性减弱:NaOH>Mg(OH)2>Al(OH)3酸性减弱:HNO3>H3PO4碱性增强:LiOH<NaOH<KOH非金属简单氢化物的稳定性增强:SiH4<PH3<H2S<HCl减弱:HF>HCl>HBr>HI原子半径减小:Si>P>S>Cl增大:F<Cl<Br<I阳离子半径减小:Na+>Mg2+>Al3+增大:Li+<Na+<K+阴离子半径减小:P3->S2->Cl-增大:F-<Cl-<Br-<I-(2)金属性和非金属性的比较方法①非金属性强弱判断:a.与氢气化合越容易,非金属性越强;b.简单氢化物越稳定,非金属性越强;c.最高价氧化物对应水化物的酸性越强,非金属性越强;d.单质的氧化性越强,非金属性越强。②金属性强弱判断:a.金属与水或酸反应置换H2越容易(反应越剧烈),金属性越强;b.最高价氧化物对应水化物的碱性越强,金属性越强;c.单质的还原性越强(对应离子的氧化性越弱),金属性越强。3.微粒的特性结构(1)熟记主族元素的价层电子排布式ⅠA:ns1ⅡA:ns2ⅢA:ns2np1ⅣA:ns2np2ⅤA:ns2np3ⅥA:ns2np4ⅦA:ns2np5(2)掌握第四周期副族元素的价层电子排布式Sc:3d14s2Ti:3d24s2V:3d34s2Cr:3d54s1Mn:3d54s2Fe:3d64s2Co:3d74s2Ni:3d84s2Cu:3d104s1Zn:3d104s24.常中的共价目见结构键数小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)卤素原子或氢原子能形成一个共价键。(2)O、S能形成两个共价键,也可能形成若干配位键。(3)N、P能形成三个共价键,也可能形成三个共价键、一个配位键,P还能形成五个共价键。(4)C、Si能形成四个共价键,C也可以形成双键或三键。(5)B能形成三个共价键,也可以形成三个共价键、一个配位键。1.(2024·新卷,课标11)我国科学家最近研究的一种无机盐Y3¿纳米药物具有高效的细胞内亚铁离子捕获和抗氧化能力。W、X、Y、Z的原子序数依次增加,且W、X、Y属于不同族的短周期元素。W的外层电子数是其内层电子数的2倍,X和Y的第一电离能都比左右相邻元素的高。Z的M层未成对电子数为4。下列叙述错误的是()A.W、X、Y、Z四种元素的单质中Z的熔点最高B.在X的简单氢化物中X原子轨道杂化类型为sp3C.Y的氢氧化物难溶于NaCl溶液,可以溶于NH4Cl溶液D.Y3¿中WX-提供电子对与Z3+形成配位键答案A解析W、X、Y、Z的原子序依次增加,且数W、X、Y于不同族的短周期元素。属W的外子是其层电数子的内层电数2倍,则W为C元素;每周期的第个ⅡA和第ⅤA族元素的第一离能都比左右相元素电邻的高,由于配合物Y3¿中Y在外界,明说Y可以形成离子,故简单阳X和Y分别为N和Mg;Z的M未层成子对电数为4,其价子排布式层电为3d64s2,Z为Fe元素,Y3¿为Mg3¿。W、X、Y、Z四元素的种单质中,C元素形成的金石熔点最高,刚A;错误X的化物是简单氢NH3,其中N原子道化型轨杂类为sp3,B正确;Y的化物是氢氧Mg(OH)2,溶于难NaCl溶液,由于NH4Cl强酸弱,其溶液因为碱盐NH4+¿¿水解显酸性,可溶解Mg(OH)2,C正确;Mg3¿中Fe3+有空道,轨CN-提供子电对与Fe3+形成配位,键D正确。2.(2024·黑吉,辽11)如下反应相关元素中,W、X、Y、Z为原子序数依次增大的短周期元素,基态X原子的核外电子有5种空间运动状态,基态Y、Z原子有两个...