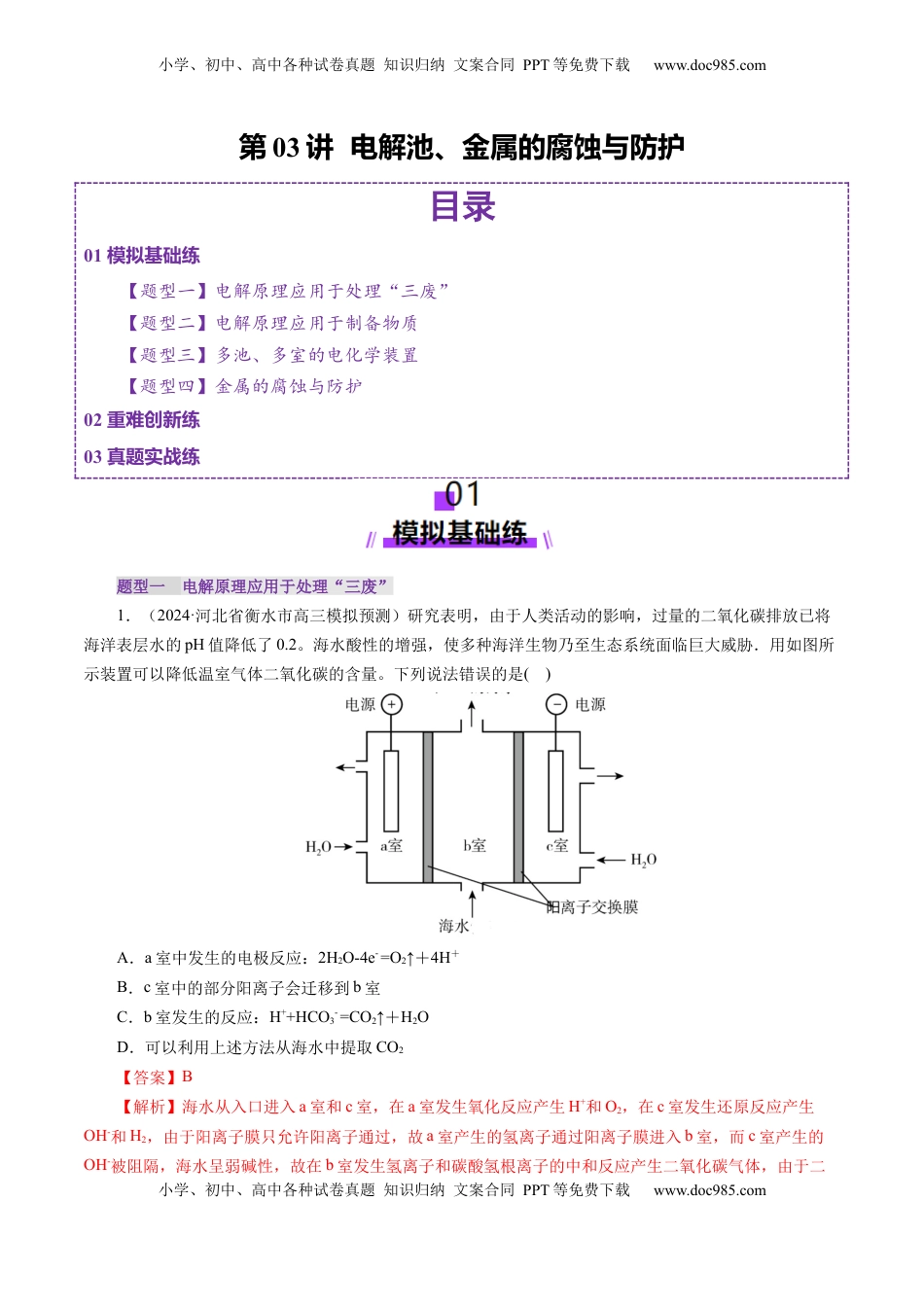
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第03讲电解池、金属的腐蚀与防护目录01模拟基础练【题型一】电解原理应用于处理“三废”【题型二】电解原理应用于制备物质【题型三】多池、多室的电化学装置【题型四】金属的腐蚀与防护02重难创新练03真题实战练题型一电解原理应用于处理“三废”1.(2024·河北省衡水市高三模拟预测)研究表明,由于人类活动的影响,过量的二氧化碳排放已将海洋表层水的pH值降低了0.2。海水酸性的增强,使多种海洋生物乃至生态系统面临巨大威胁.用如图所示装置可以降低温室气体二氧化碳的含量。下列说法错误的是()A.a室中发生的电极反应:2H2O-4e-=O2↑+4H+B.c室中的部分阳离子会迁移到b室C.b室发生的反应:H++HCO3-=CO2↑+H2OD.可以利用上述方法从海水中提取CO2【答案】B【解析】海水从入口进入a室和c室,在a室发生氧化反应产生H+和O2,在c室发生还原反应产生OH-和H2,由于阳离子膜只允许阳离子通过,故a室产生的氢离子通过阳离子膜进入b室,而c室产生的OH-被阻隔,海水呈弱碱性,故在b室发生氢离子和碳酸氢根离子的中和反应产生二氧化碳气体,由于二小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com氧化碳气体微溶于水,故二氧化碳气体从海水中分离。A项,水从入口进入a室和c室,在a室发生氧化反应产生H+和O2,电极方程式为:2H2O-4e-=O2↑+4H+,A正确;B项,c室为阴极区,a室为阳极区,电解池中阳离子向阴极移动,B错误;C项,b室发生氢离子和碳酸氢根离子的中和反应产生二氧化碳气体,离子方程式为:H++HCO3-=CO2↑+H2O,C正确;D项,b室发生氢离子和碳酸氢根离子的中和反应产生二氧化碳气体,由于二氧化碳气体微溶于水,故二氧化碳气体从海水中分离,D正确;故选B。2.某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是()A.A为电源正极B.阳极区溶液中发生的氧化还原反应为Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2OC.阴极区附近溶液pH降低D.若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.1molCr2O被还原【答案】C【解析】根据图示,A作阳极,B作阴极,电极反应式为,阳极:Fe-2e-===Fe2+;阴极:2H++2e-===H2↑;然后,Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,由于在阴极区c(H+)减小,pH增大。根据6H2~6Fe2+~Cr2O得,当有13.44L(标准状况)H2放出时,应有0.1molCr2O被还原。3.隔膜电解法处理酸性的硝基苯废水,采用惰性电极,装置示意图如下,下列说法正确的是()A.阴极反应为:+6H++6e-===+2H2OB.隔膜应为阴离子交换膜C.电解工作一段时间后,需补加Na2SO4小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comD.生成与O2的物质的量之比为1∶1【答案】A【解析】电池右边实现了C6H5NO2→C6H7N的转变,N元素的化合价从+3价变到-3价,化合价降低,发生还原反应,对应电极为阴极,故阴极的电极反应式为:C6H5NO2+6e-+6H+===C6H7N+2H2O,A正确;交换膜允许H+通过,为阳离子交换膜,B错误;阳极电极反应式为:4OH--4e-===O2↑+2H2O,没有消耗钠离子和硫酸根,不需补加硫酸钠,C错误;阴极电极反应式为C6H5NO2+6e-+6H+===C6H7N+2H2O,每生成1molC6H7N转移电子数为6mol,阳极电极反应式为4OH--4e-===O2↑+2H2O,每转移6mol电子生成1.5molO2,则生成与O2的物质的量之比为1∶1.5=2∶3,D错误;故答案选A。4.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。(2)SO放电的电极反应式为____________。(3)电解过程中阴极区碱性明显增强,用平衡移动...