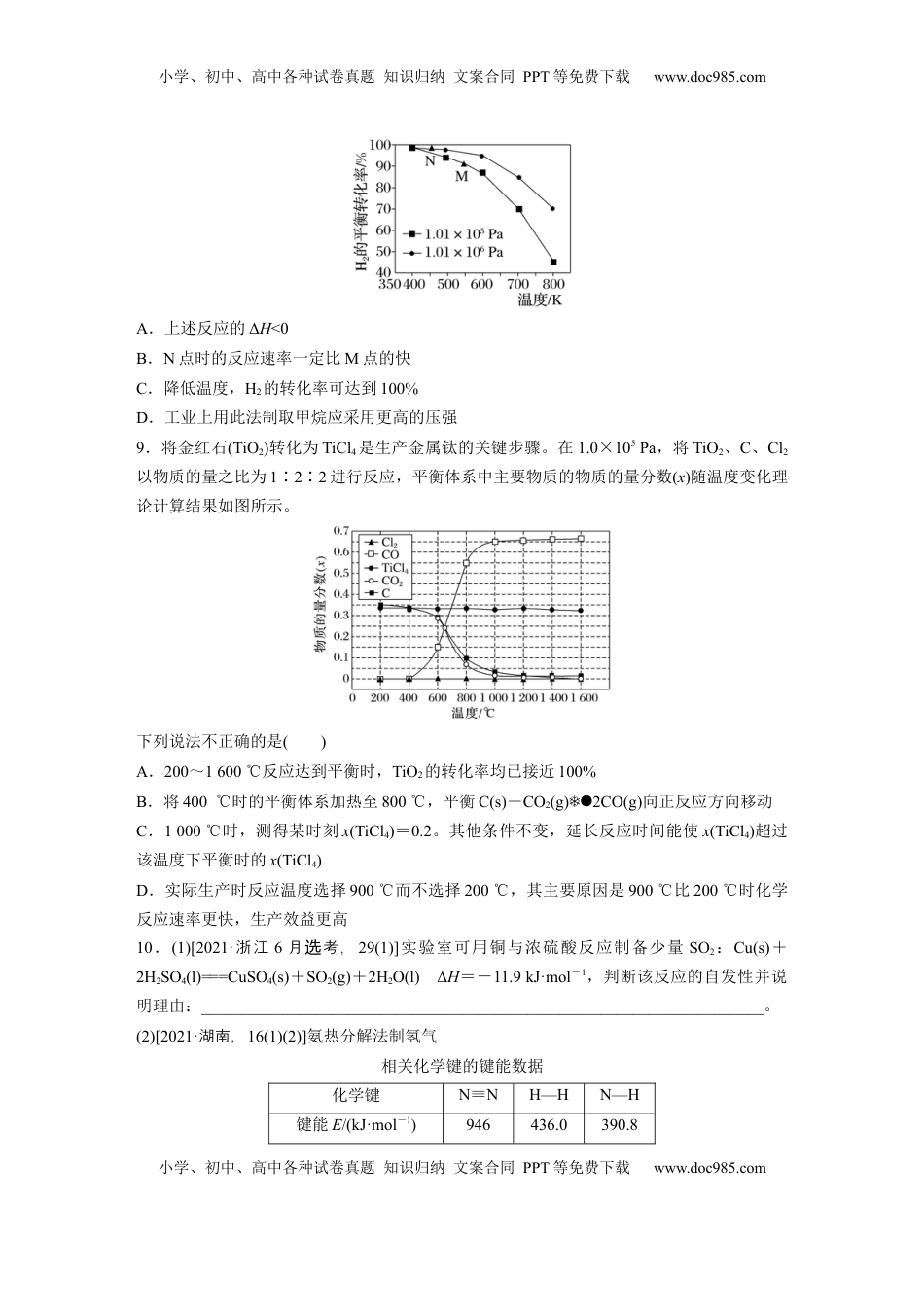
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.25℃、1.01×105Pa时,反应2N2O5(g)===4NO2(g)+O2(g)ΔH=+109.8kJ·mol-1,该反应能自发进行的原因是()A.该反应是吸热反应B.该反应是放热反应C.该反应是熵减小的反应D.该反应的熵增大效应大于能量效应2.下列反应在任何温度下均能自发进行的是()A.2N2(g)+O2(g)===2N2O(g)ΔH=+16kJ·mol-1B.Ag(s)+Cl2(g)===AgCl(s)ΔH=-127kJ·mol-1C.HgO(s)===Hg(l)+O2(g)ΔH=+91kJ·mol-1D.H2O2(l)===O2(g)+H2O(l)ΔH=-98kJ·mol-13.下列对化学反应的预测正确的是()选项化学方程式已知条件预测AA(s)===B(g)+C(s)ΔH>0它一定是非自发反应BA(g)+2B(g)===2C(g)+3D(g)能自发反应ΔH一定小于0CM(s)+aN(g)===2Q(g)ΔH<0,自发反应a可能等于1、2、3DM(s)+N(g)===2Q(s)常温下,自发进行ΔH>04.合成氨反应达到平衡时,NH3的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是()A.提高分离技术B.研制耐高压的合成塔C.研制低温催化剂D.探索不用N2和H2合成氨的新途径5.(2023·一模青岛)2007年诺贝尔化学奖颁给了德国化学家格哈德·埃特尔(GerhardErtl),以表彰他在固体表面化学研究中取得的开拓性成就。他的成就之一是证实了氢气与氮气在固体小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com催化剂表面合成氨气的反应过程,模拟示意图如图。关于合成氨工艺,下列说法正确的是()A.图①到图③的活化能减去图⑤到图③的活化能就是合成氨反应的反应热B.反应中有极性键的断裂与形成C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率D.合成氨反应使用的条件高温、高压是为了提高反应物的平衡转化率6.已知体系自由能变化ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,两个氢化反应的ΔG与温度的关系如图所示,下列说法正确的是()A.反应①的ΔS<0B.反应②在600℃时的反应速率很快C.温度大于1000℃时,反应①能自发进行D.反应②的ΔH>07.在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)LaNi5H6(s)ΔH=-301kJ·mol-1。在某温度下,达到平衡状态,测得氢气压强为2MPa。下列说法不正确的是()A.当LaNi5的浓度不再变化时,该反应达到平衡状态B.若温度不变,缩小容器的容积至原来的一半,重新达到平衡时H2的压强等于2MPaC.扩大容器的容积,重新达到平衡时n(H2)增多D.增大压强,降低温度,有利于储氢8.已知反应:CO(g)+3H2(g)CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.上述反应的ΔH<0B.N点时的反应速率一定比M点的快C.降低温度,H2的转化率可达到100%D.工业上用此法制取甲烷应采用更高的压强9.将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105Pa,将TiO2、C、Cl2以物质的量之比为1∶2∶2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。下列说法不正确的是()A.200~1600℃反应达到平衡时,TiO2的转化率均已接近100%B.将400℃时的平衡体系加热至800℃,平衡C(s)+CO2(g)2CO(g)向正反应方向移动C.1000℃时,测得某时刻x(TiCl4)=0.2。其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)D.实际生产时反应温度选择900℃而不选择200℃,其主要原因是900℃比200℃时化学反应速率更快,生产效益更高10.(1)[2021·浙江6月考,选29(1)]实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)===CuSO4(s)+SO2(g)+2H2O(l)ΔH=-11.9kJ·mol-1,判断该反应的自发性并说明理由:__________...