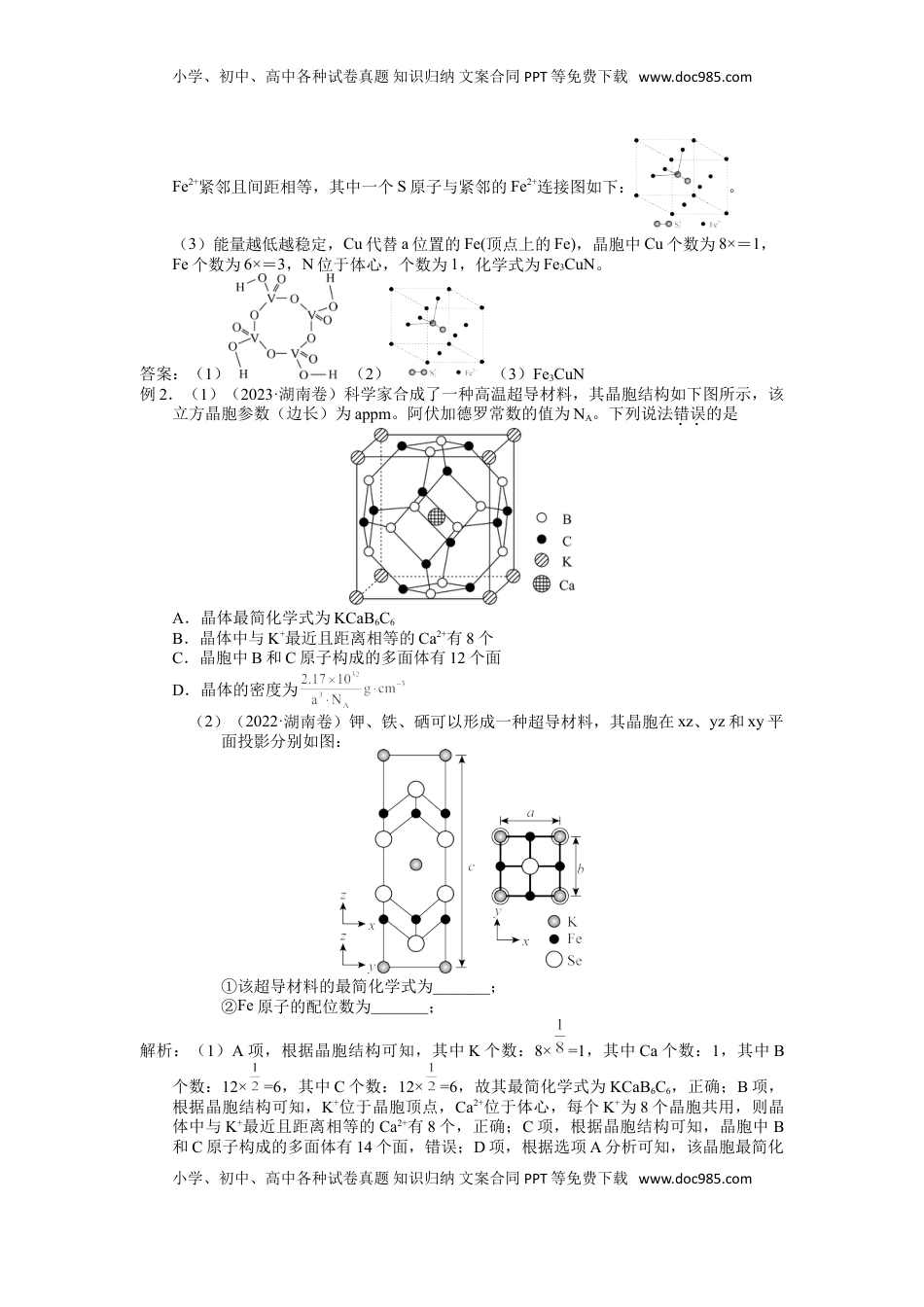
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2025届高三化学一轮专题复习讲义(07)专题二物质结构2-3晶体结构与性质(1课时)【复习目标】1.能运用离子键、配位键、金属键等模型,解释离子化合物、配合物、金属等物质的某些典型性质。2.能说出晶体与非晶体的区别;能结合实例描述晶体中微粒排列的周期性规律ce借助于分子晶体、共价晶体、离子晶体、金属晶体等的微粒及其微粒间的相互作用力。3.能从微粒的空间排布及其相互作用的角度对生产、生活、科学研究中的简单安全进行分析,举例说明物质结构研究的应用价值。【重点突破】1.常见晶体的性质与结构的分析。【真题再现】例1.(1)(2023·江苏卷)钒酸中含有H4V4O12。已知H4V4O12具有八元环结构,其结构式可表示为。(2)(2022·江苏卷)FeS2具有良好半导体性能。FeS2的一种晶体与NaCl晶体的结构相似,该晶体的一个晶胞中S的数目为_______,在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,如图给出了FeS2晶胞中的Fe2+和位于晶胞体心的S(S中的S—S键位于晶胞体对角线上,晶胞中的其他S已省略)。如图中用“—”将其中一个S原子与紧邻的Fe2+连接起来_______。(3)(2019·江苏卷)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。解析:(1)因为H4V4O12具有八元环结构,只能是V和O形成八元环,V连有五根共价键,故结构式为:;(2)因为FeS2的晶体与NaCl晶体的结构相似,由NaCl晶体结构可知,一个NaCl晶胞含有4个Na+和4个Cl-,则该FeS2晶体的一个晶胞中S的数目也为4;FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,根据FeS2晶胞中的Fe2+和S的位置(S中的S—S键位于晶胞体对角线上)可知,每个S原子与S—S键所在体对角线上距离最近的顶点相邻的三个面的三个面心位置的小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comFe2+紧邻且间距相等,其中一个S原子与紧邻的Fe2+连接图如下:。(3)能量越低越稳定,Cu代替a位置的Fe(顶点上的Fe),晶胞中Cu个数为8×=1,Fe个数为6×=3,N位于体心,个数为1,化学式为Fe3CuN。答案:(1)(2)(3)Fe3CuN例2.(1)(2023·湖南卷)科学家合成了一种高温超导材料,其晶胞结构如下图所示,该立方晶胞参数(边长)为appm。阿伏加德罗常数的值为NA。下列说法错误的是A.晶体最简化学式为KCaB6C6B.晶体中与K+最近且距离相等的Ca2+有8个C.晶胞中B和C原子构成的多面体有12个面D.晶体的密度为(2)(2022·湖南卷)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图:①该超导材料的最简化学式为_______;②Fe原子的配位数为_______;解析:(1)A项,根据晶胞结构可知,其中K个数:8×=1,其中Ca个数:1,其中B个数:12×=6,其中C个数:12×=6,故其最简化学式为KCaB6C6,正确;B项,根据晶胞结构可知,K+位于晶胞顶点,Ca2+位于体心,每个K+为8个晶胞共用,则晶体中与K+最近且距离相等的Ca2+有8个,正确;C项,根据晶胞结构可知,晶胞中B和C原子构成的多面体有14个面,错误;D项,根据选项A分析可知,该晶胞最简化小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com学式为KCaB6C6,则1个晶胞质量为:,晶胞体积为a3×10-30cm3,则其密度为,正确。(2)①由平面投影图可知,晶胞中位于顶点和体心的钾原子个数为8×+1=2,铁原子位于面心,原子个数为8×=4,位于棱上和体心的硒原子的个数为8×+2=4,则超导材料最简化学式为KFe2Se2;②由平面投影图可知,位于棱上的铁原子与位于面上的硒原子的距离最近,所以铁原子的配位数为4。答案:(1)C(2)①KFe2Se2②4【知能整合】1.明确晶体类型的两种判断方法(1)据各类晶体的概念判断,即根据构成晶体的粒子...