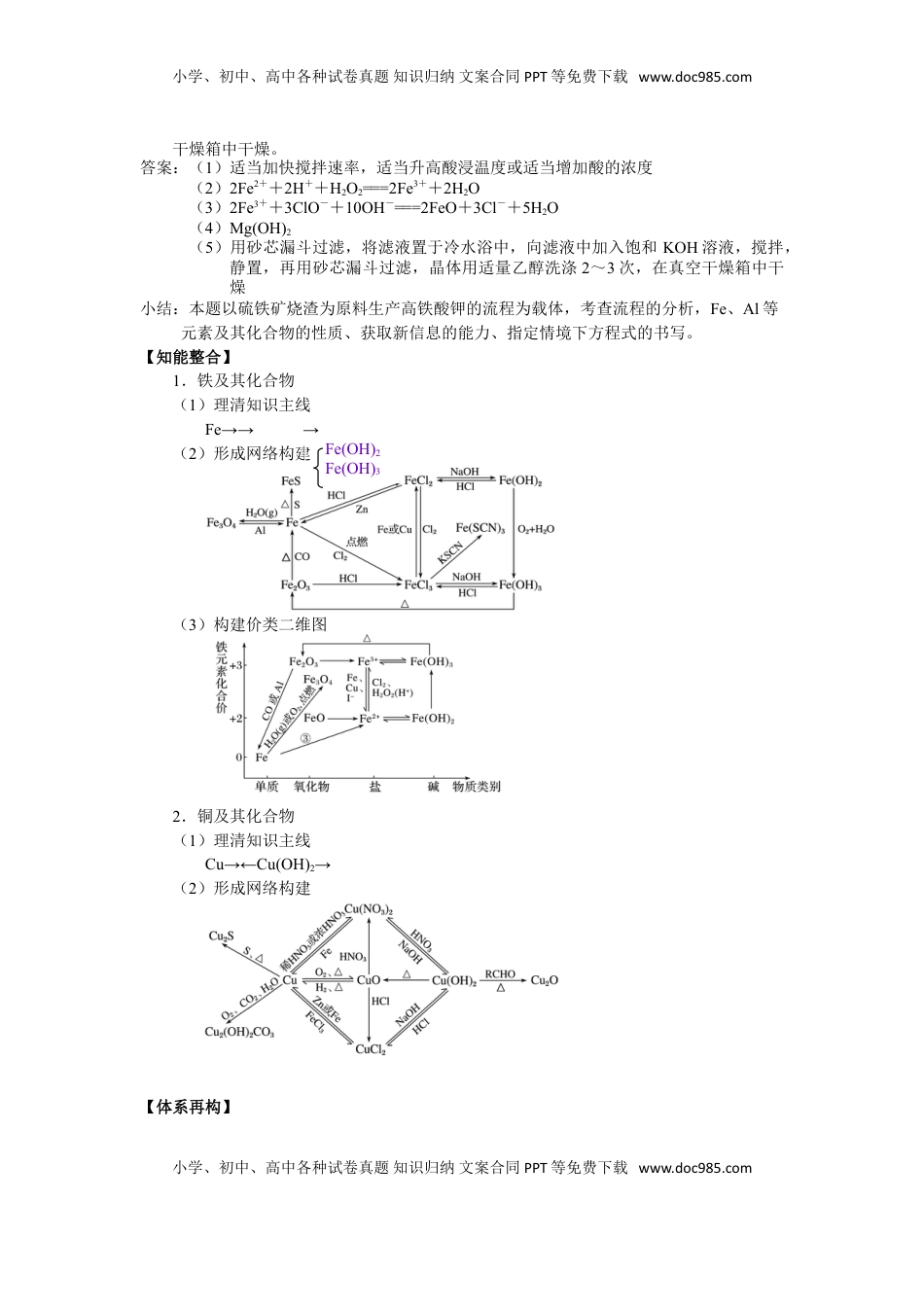
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2025届高三化学一轮专题复习讲义(17)专题四元素及其化合物4-2金属及其化合物(二、铁铜及其化合物)(1课时,共2课时)【复习目标】1.掌握铁、铜及其重要化合物主要性质及应用;2.了解铁、铜及其重要化合物的制备方法;3.掌握铁、铜及其重要化合物的转化关系;4.理解化工流程及实验室中铁、铜及其化合物的转化原理及条件分析。【重点突破】1.掌握铁、铜及其重要化合物的转化关系及应用2.精准理解铁、铜及其化合物在化工流程及实验室中转化原理和条件分析【真题再现】例题1.以硫铁矿烧渣(主要成分为FeO、Fe2O3、少量SiO2、MgO、Al2O3)为原料,生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:已知K2FeO4具有下列性质:①可溶于水、微溶于浓KOH溶液;②在0~5℃强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解。(1)酸浸酸浸时,为提高铁元素的浸出率,可以采取的措施有______________。(2)氧化氧化时发生反应的离子方程式为_________________________________。(3)制备Na2FeO4制备Na2FeO4溶液的离子方程式为____________________。(4)过滤滤渣2的主要成分是____________(填化学式)(5)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案:将一定量的K2FeO4粗产品溶于冷的3mol·L-1KOH溶液中,____________________。(实验中须使用的试剂:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱)解析:(1)酸浸时,为提高铁元素的浸出率,可以适当加快搅拌速率,适当升高酸浸温度或适当增加酸的浓度。(2)酸性条件下,H2O2把Fe2+氧化成Fe3+,注意氧化还原离子方程式的配平。(3)ClO-有强氧化性,在碱性溶液中把Fe3+氧化成FeO,注意氧化还原离子方程式的配平(满足3个守恒:得失电子守恒、电荷守恒、质量守恒)。(4)SiO2在第一次过滤时已除去,Al2O3溶于NaOH生成AlO,故滤渣2的主要成分是Mg(OH)2。(5)根据已知条件,K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液;②在0~5℃强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解,可知将一定量的K2FeO4粗产品溶于冷的3mol·L-1KOH溶液中,由于K2FeO4在0~5℃强碱性溶液中较稳定,此时的沉淀是Fe(OH)3,用砂芯漏斗过滤除去;将滤液置于冷水浴中,向滤液中加入饱和KOH溶液,由于K2FeO4微溶于浓KOH溶液,以沉淀形式析出,搅拌,静置,再用砂芯漏斗过滤;最后晶体用适量乙醇洗涤2~3次,在真空小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com干燥箱中干燥。答案:(1)适当加快搅拌速率,适当升高酸浸温度或适当增加酸的浓度(2)2Fe2++2H++H2O2===2Fe3++2H2O(3)2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O(4)Mg(OH)2(5)用砂芯漏斗过滤,将滤液置于冷水浴中,向滤液中加入饱和KOH溶液,搅拌,静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次,在真空干燥箱中干燥小结:本题以硫铁矿烧渣为原料生产高铁酸钾的流程为载体,考查流程的分析,Fe、Al等元素及其化合物的性质、获取新信息的能力、指定情境下方程式的书写。【知能整合】1.铁及其化合物(1)理清知识主线Fe→→→(2)形成网络构建(3)构建价类二维图2.铜及其化合物(1)理清知识主线Cu→←Cu(OH)2→(2)形成网络构建【体系再构】小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comFe(OH)2Fe(OH)3小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【随堂反馈】基础训练1.(2023·南京模拟)用铁制备较纯净的氧化铁,下列实验方案最好的是A.使铁在潮湿的空气中缓慢氧化B.铁在氯气中燃烧,加水溶解,加入足量NaOH溶液,过滤、洗涤,然后充分加热分解C.使铁溶解于稀硫酸,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解D.使铁与足量稀硝酸反应,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解2.FeCl3固体易潮解,在300℃以上可升...