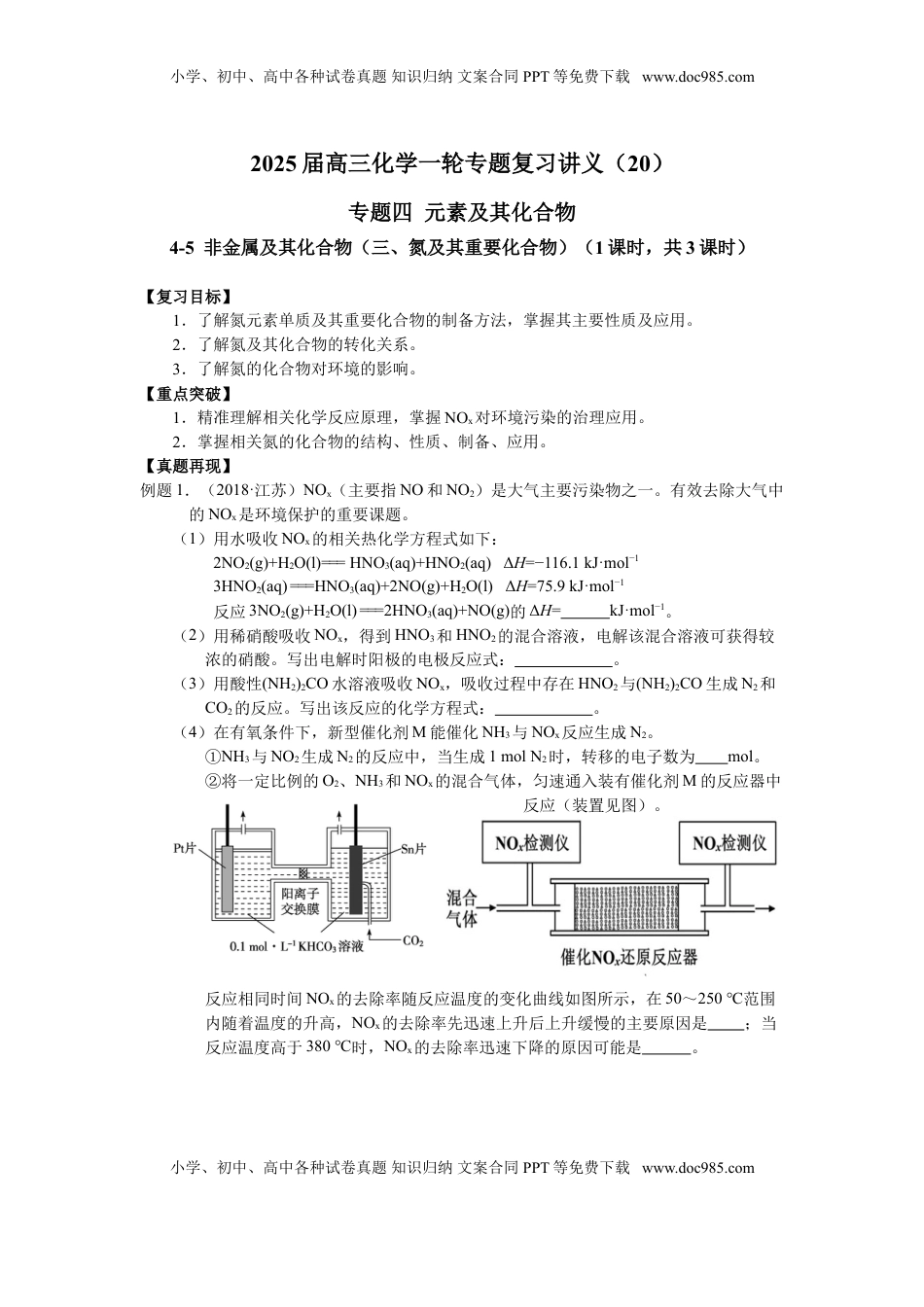
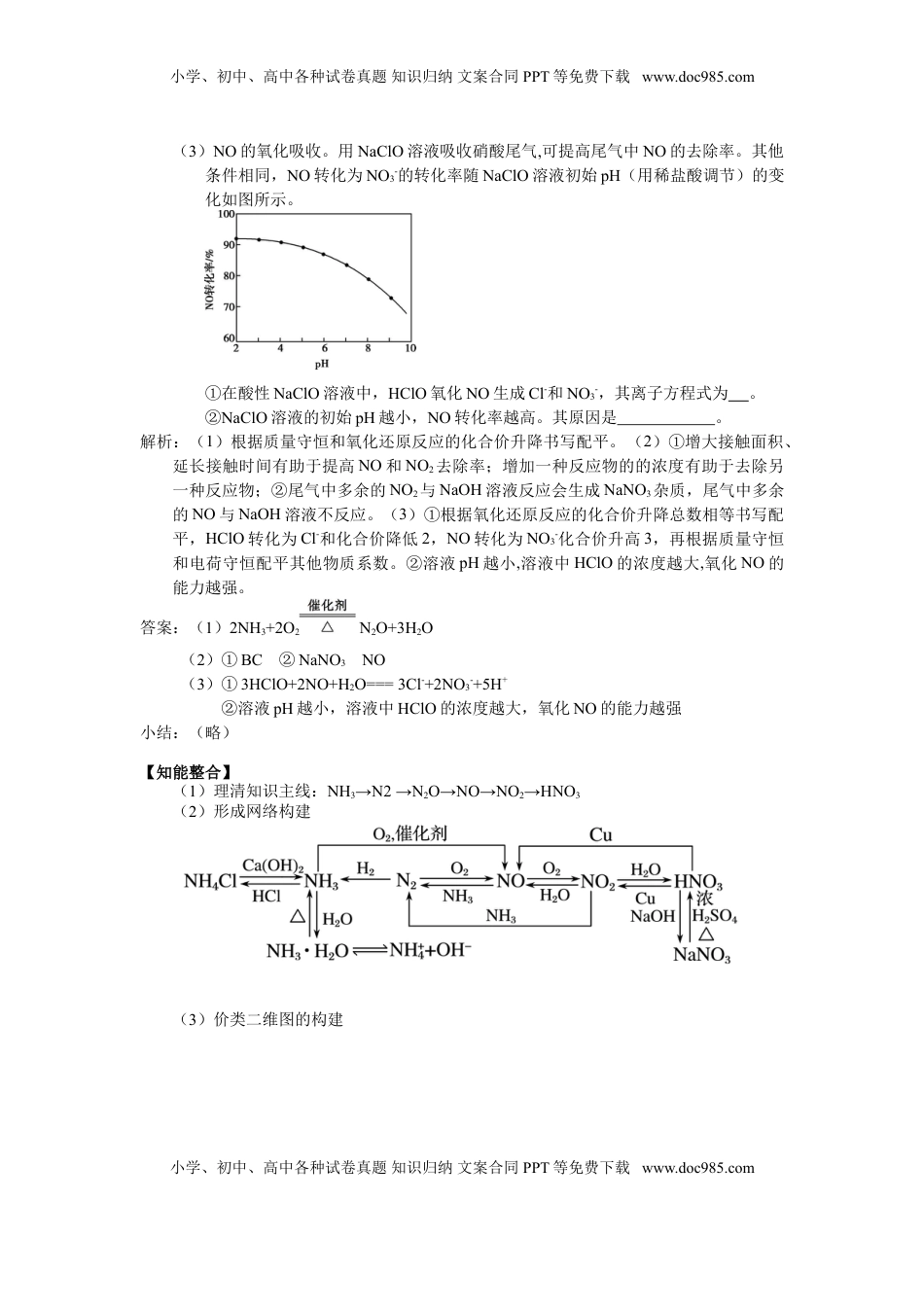
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2025届高三化学一轮专题复习讲义(20)专题四元素及其化合物4-5非金属及其化合物(三、氮及其重要化合物)(1课时,共3课时)【复习目标】1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及应用。2.了解氮及其化合物的转化关系。3.了解氮的化合物对环境的影响。【重点突破】1.精准理解相关化学反应原理,掌握NOx对环境污染的治理应用。2.掌握相关氮的化合物的结构、性质、制备、应用。【真题再现】例题1.(2018·江苏)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。(1)用水吸收NOx的相关热化学方程式如下:2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq)ΔH=−116.1kJ·mol−13HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l)ΔH=75.9kJ·mol−1反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的ΔH=kJ·mol−1。(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:。(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:。(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子数为mol。②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com。解析:(1)应用盖斯定律解答。(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失去电子生成HNO3。(3)HNO2与(NH2)2CO反应生成N2和CO2,根据得失电子守恒和原子守恒写出方程式。(4)①NH3与NO2的反应为8NH3+6NO27N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7molN2转移24mol电子。②因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应生成NO。答案:(1)−136.2(2)HNO2−2e−+H2O===3H++NO3−(3)2HNO2+(NH2)2CO===2N2↑+CO2↑+3H2O(4)24/7(5)迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大(6)催化剂活性下降;NH3与O2反应生成了NO小结:本题以有效去除NOx为载体,考查盖斯定律的应用、电解原理、指定情境下方程式的书写,氧化还原反应中转移电子数的计算、图像的分析。主要体现的是对化学反应原理的考查,对化学反应原理的准确理解是解题的关键。例2.(2019江苏)N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为。(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-===2NO2-+H2O2NO2+2OH-===NO2-+NO3-+H2O①下列措施能提高尾气中NO和NO2去除率的有(填字母)。A.加快通入尾气的速率B.采用气、液逆流的方式吸收尾气C.吸收尾气过程中定期补加适量NaOH溶液②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,所得晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-...