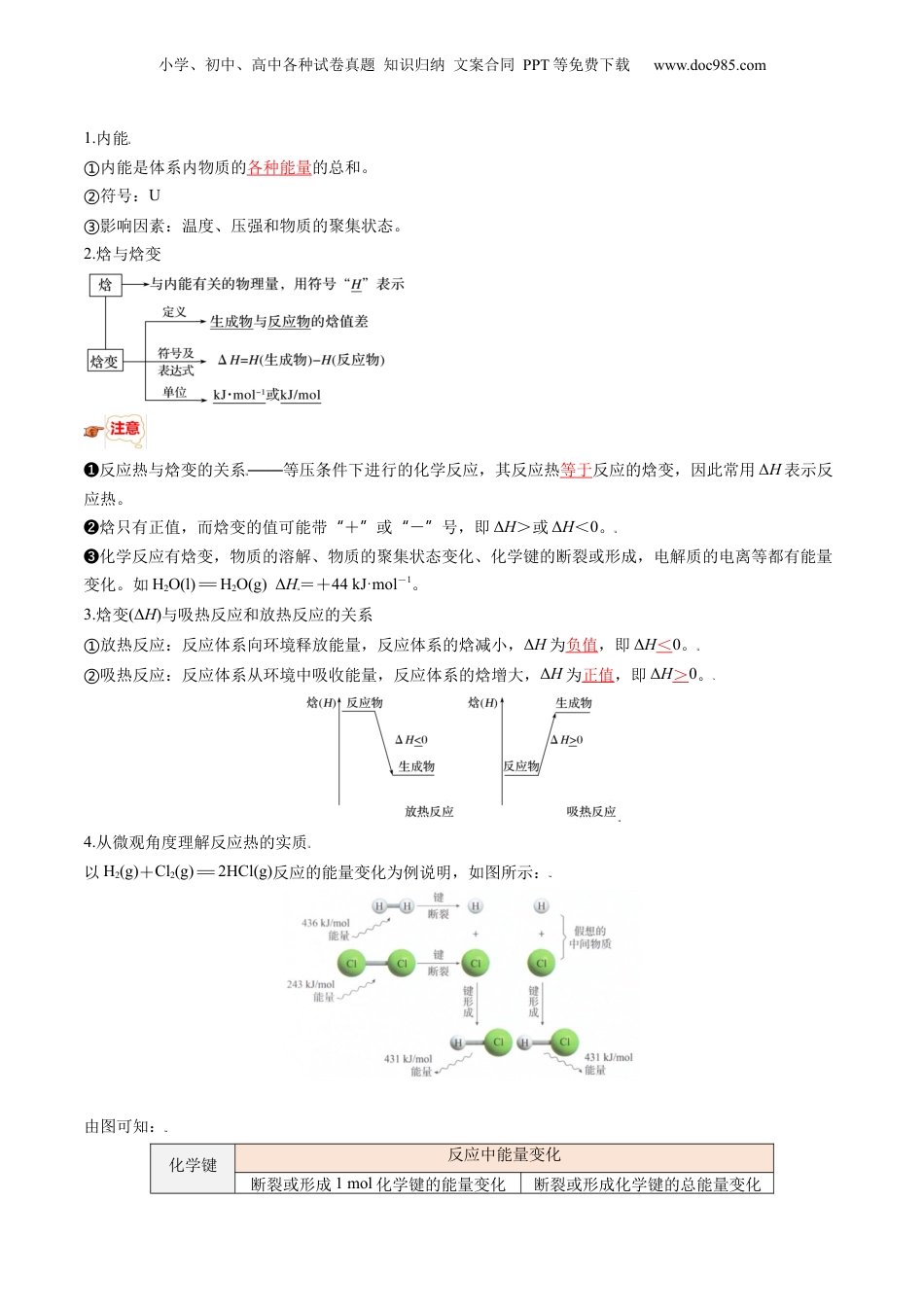
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第01讲反应热模块一思维导图串知识模块二基础知识全梳理模块三重点难点必掌握模块四核心考点精准练模块五小试牛刀过关测1.了解反应热及其测定,掌握中和反应反应热的测定方法;能根据实验中测定并记录的数据计算反应热。2.能从宏观和微观两个角度构建模型,了解反应热与焓变的含义,能够进行反应热的简单计算。3.认识热化学方程式,了解热化学方程式表示的意义。4.理解热化学方程式书写规则,能用热化学方程式表示反应中的能量变化。5.认识燃烧热,能正确书写关于燃烧热的热化学方程式。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com自然界的能量存在形式有很多种:势能、生物能、热能、太阳能、风能等。其中热量的释放或吸收是化学反应中能量变化的常见形式,如下表。钠与水反应H2在Cl2中燃烧氯化铵与氢氧化钡反应煅烧石灰石反应放热反应放热反应吸热反应吸热如何定量描述化学反应过程释放或吸收的热量?课时1反应热焓变一.反应热及其测定1.体系与环境以盐酸与NaOH溶液的反应为例体系体系是与周围其他部分区分开来的根据需要所研究的对象。如将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称体系(系统)环境环境是与体系相互影响的其他部分。如盛有溶液的试管和溶液之外的空气等看作环境。关联体系与环境之间存在物质交换或能量交换。2.反应热概念在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。热量:指因温度不同而在体系与环境之间交换或传递的能量。3.反应热测定通常可用量热计直接测定。化学反应的实质和特征化学反应为什么会产生反应热?化学反应前后体系的的内能发生了变化。二.反应热与焓变小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.内能内能是体系内物质的①各种能量的总和。符号:②U影响因素:温度、压强和物质的聚集状态。③2.焓与焓变❶反应热与焓变的关系——等压条件下进行的化学反应,其反应热等于反应的焓变,因此常用ΔH表示反应热。❷焓只有正值,而焓变的值可能带+或-号,即“”“”ΔH>或ΔH<0。❸化学反应有焓变,物质的溶解、物质的聚集状态变化、化学键的断裂或形成,电解质的电离等都有能量变化。如H2O(l)=H2O(g)ΔH=+44kJ·mol-1。3.焓变(ΔH)与吸热反应和放热反应的关系放热反应:反应体系向环境释放能量,反应体系的焓减小,①ΔH为负值,即ΔH<0。吸热反应:反应体系从环境中吸收能量,反应体系的焓增大,②ΔH为正值,即ΔH>0。4.从微观角度理解反应热的实质以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:由图可知:化学键反应中能量变化断裂或形成1mol化学键的能量变化断裂或形成化学键的总能量变化小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comH—H吸收436kJ共吸收679kJCl—Cl吸收243kJH—Cl放出431kJ共放出862kJ结论H2(g)+Cl2(g)=2HCl(g)的反应热ΔH=-183kJ·mol-1图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:①其中,E1表示反应物断裂化学键吸收的总热量,E2表示生成物形成化学键放出的总热量,E1与E2的差值表示反应热。上述反应过程表示该反应为放热反应。焓变计算公式:②ΔH=E总(断键)-E总(成键)或ΔH=E总(反应物)-E总(生成物)。1.吸热反应和放热反应均为化学变化。2.吸热反应和放热反应与反应条件没有必然联系,需要加热的反应也可能是放热反应。3.一般来说,物质具有的能量越低,物质越稳定;物质内的总键能越大,物质越稳定。4.加入催化剂可以使反应历程能量曲线的山峰降低,改变了反应历程,但加入催化剂前后反应物—“”和生成物的总能量差不变,即前后的落差不变,故加入催化剂不影响反应的“”ΔH,如图所示(图中b曲线表示加入催化剂后的能量变化)。5.一般情况下,热化学方程式中不用、来表示气体和沉淀。“↑”“↓”课时2热化学方程式燃烧热一.热化学方程式概念表明反应所释放或吸收的热量的化学方程式意义不仅表示化学反应中的...