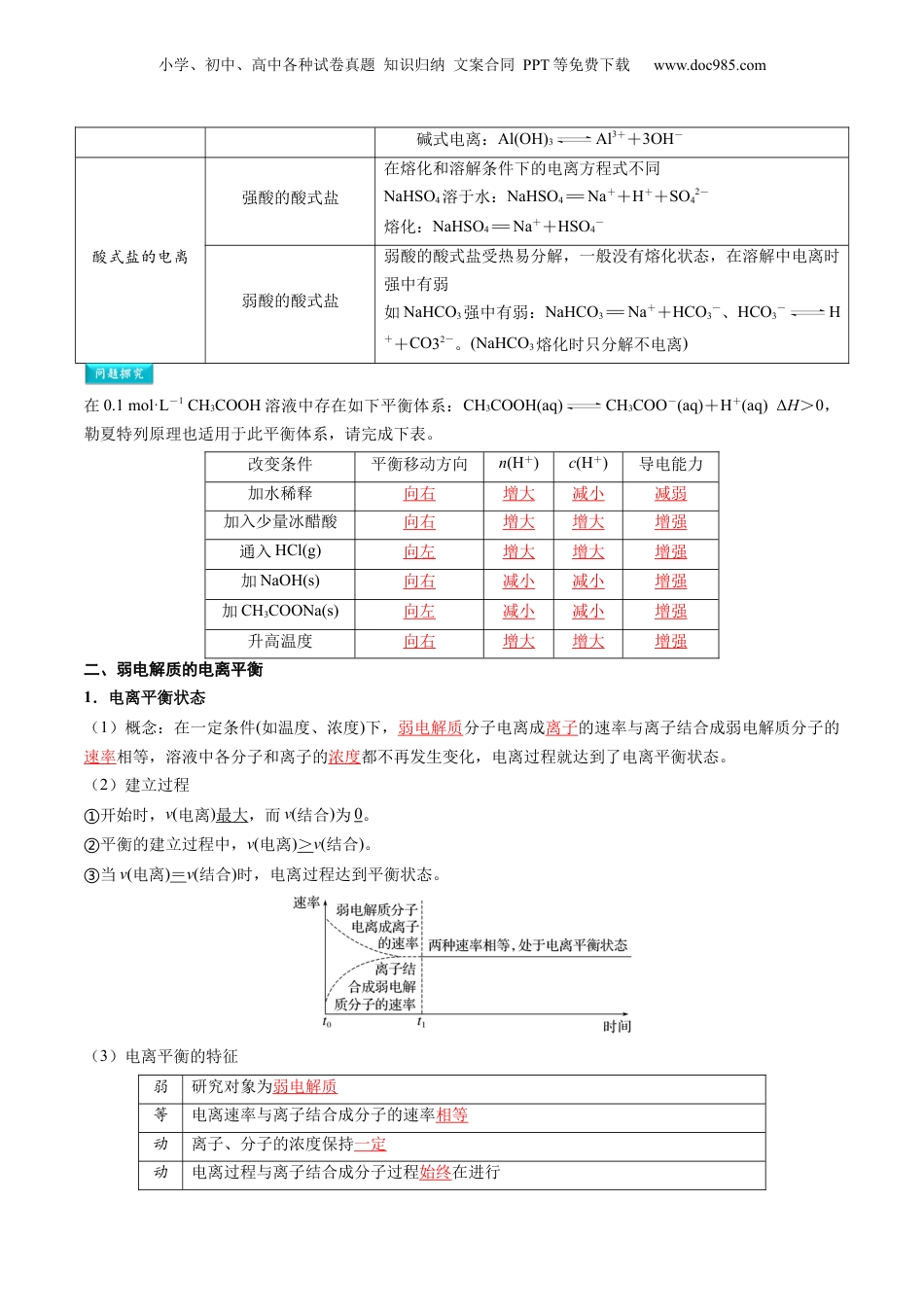
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第08讲电离平衡模块一思维导图串知识模块二基础知识全梳理模块三重点难点必掌握模块四核心考点精准练模块五小试牛刀过关测1.掌握强、弱电解质的概念和判断,能从微观层面理解强、弱电解质的本质区别。2.认识弱电解质在水溶液中存在电离平衡。能正确书写弱电解质的电离方程式,会分析电离平衡的移动。3.了解电离平衡常数的含义。能利用电离平衡常数进行相关计算。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com洁厕灵的主要成分是盐酸,用于卫生洁具的清洁。为何不用醋酸?盐酸与醋酸的性质为何不同?实验探究盐酸和醋酸的电离程度取相同体积、1.0mol·L-1的盐酸和醋酸,比较它们pH的大小,试验其导电能力,并分别与等量镁条反应。观察、比较并记录现象。酸1.0mol·L-1盐酸1.0mol·L-1醋酸pH大小较小较大导电能力较强较弱与镁条反应的现象产生无色气泡较快产生无色气泡较慢实验结论实验表明盐酸中c(H+)更大,说明盐酸的电离程度大于醋酸的电离程度一、强电解质和弱电解质1.强弱电解质的比较强电解质弱电解质相同点在水溶液中都能电离,与溶解度无关不同点电离程度完全电离部分电离溶质粒子存在形式离子只有电离出的阴阳离子既有电离出的阴阳离子分子无电解质分子又有电解质分子表示方法用“=表示”KCl=K++Cl-用“”表示NH3·H2ONH+OH—结构特点离子化合物及具有强极性键的共价化合物某些具有弱极性键的共价化合物化合物类型绝大多数盐:NaCl、KNO3、AgCl强酸:HCl、HNO3、H2SO4、HBr、HI强碱:NaOH、KOH、Ba(OH)2弱酸:HClO、HNO2弱碱:NH3·H2OCu(OH)2水:H2O少数盐:HgCl2、PbAc22.电离方程式的书写强电解质完全电离用“=”弱电解质部分电离,用“”多元弱酸分步电离,以第一步电离为主(不可合并)如:H2SH++HS-,HS-H++S2-不能写成:H2S2H++S2-多元弱碱用一步电离表示如:Cu(OH)2Cu2++2OH-两性氢氧化物双向电离如:H++AlO2-+H2OAl(OH)3Al3++3OH-Al(OH)3两性按两种方法电离酸式电离:Al(OH)3AlO2-+H2O+H+小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com碱式电离:Al(OH)3Al3++3OH-酸式盐的电离强酸的酸式盐在熔化和溶解条件下的电离方程式不同NaHSO4溶于水:NaHSO4=Na++H++SO42-熔化:NaHSO4=Na++HSO4-弱酸的酸式盐弱酸的酸式盐受热易分解,一般没有熔化状态,在溶解中电离时强中有弱如NaHCO3强中有弱:NaHCO3=Na++HCO3-、HCO3-H++CO32-。(NaHCO3熔化时只分解不电离)在0.1mol·L-1CH3COOH溶液中存在如下平衡体系:CH3COOH(aq)CH3COO-(aq)+H+(aq)ΔH>0,勒夏特列原理也适用于此平衡体系,请完成下表。改变条件平衡移动方向n(H+)c(H+)导电能力加水稀释向右增大减小减弱加入少量冰醋酸向右增大增大增强通入HCl(g)向左增大增大增强加NaOH(s)向右减小减小增强加CH3COONa(s)向左减小减小增强升高温度向右增大增大增强二、弱电解质的电离平衡1.电离平衡状态(1)概念:在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。(2)建立过程开始时,①v(电离)最大,而v(结合)为0。平衡的建立过程中,②v(电离)>v(结合)。当③v(电离)=v(结合)时,电离过程达到平衡状态。(3)电离平衡的特征弱研究对象为弱电解质等电离速率与离子结合成分子的速率相等动离子、分子的浓度保持一定动电离过程与离子结合成分子过程始终在进行小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com变温度、浓度等条件变化,平衡就被破坏,在新的条件下,建立新的平衡2.电离平衡的影响因素电离平衡的移动符合勒夏特列原理。浓度溶液越稀,离子结合成分子机会越小,越有利于电离温度电解质电离要断键,即电离是吸热的,故升温促进电离同离子效应即加入与弱电解质具有相同离子的强电解质,则能抑制电离化学反应加入能与弱电解质电离出的离子反应的物质时,则能促进电离...