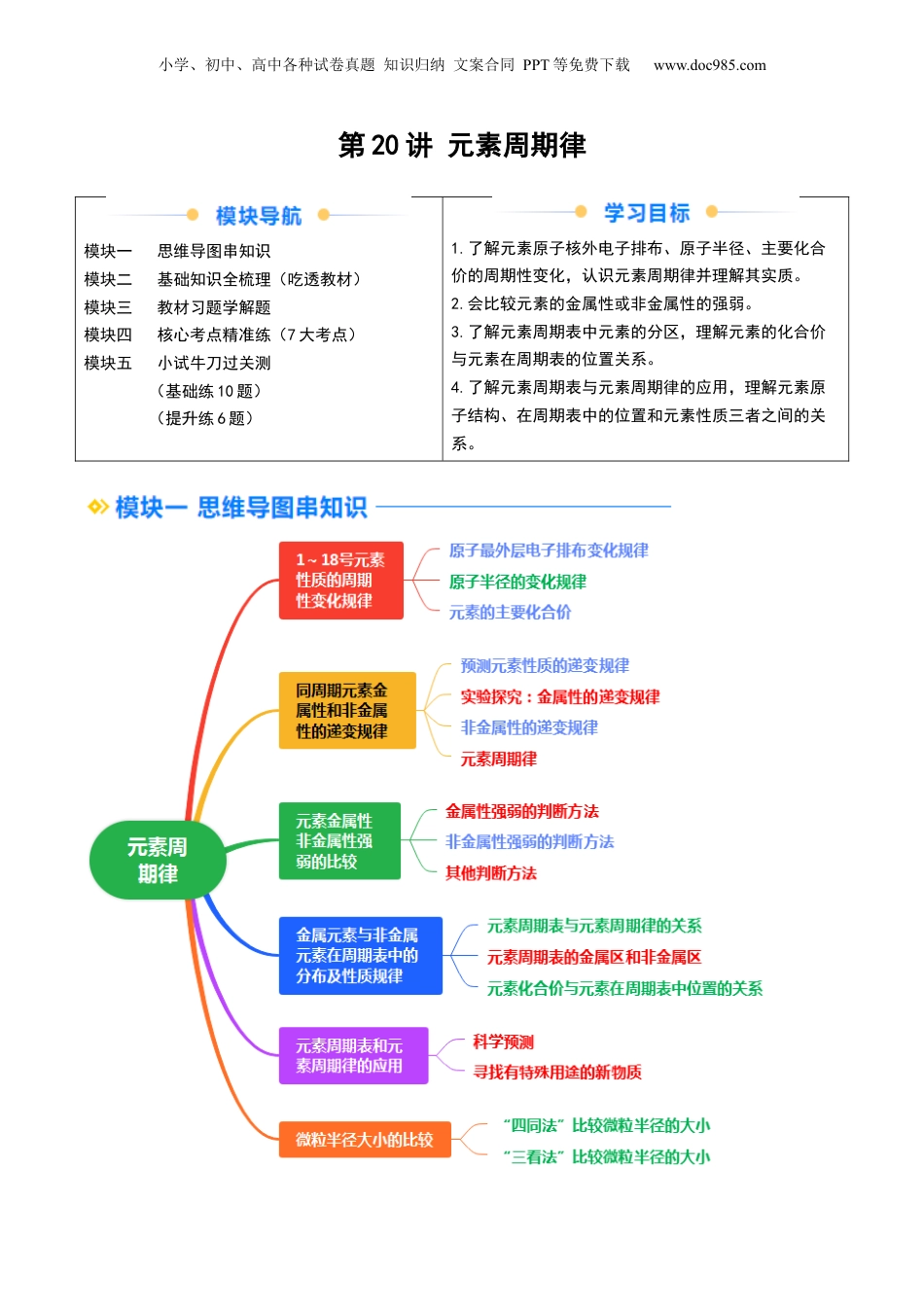
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第20讲元素周期律模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(7大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.了解元素原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律并理解其实质。2.会比较元素的金属性或非金属性的强弱。3.了解元素周期表中元素的分区,理解元素的化合价与元素在周期表的位置关系。4.了解元素周期表与元素周期律的应用,理解元素原子结构、在周期表中的位置和元素性质三者之间的关系。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com一、1~18号元素性质的周期性变化规律1.原子最外层电子排布变化规律周期序号原子序数电子层数最外层电子数结论第一周期1→211→2同周期由左向右,元素的原子最外层电子数逐渐增加(1→8,第一周期除外)第二周期3→1021→8第三周期11→1831→8规律:同周期中,随着原子序数的递增,元素原子的核外电子排布呈现周期性变化2.原子半径的变化规律(稀有气体除外)周期序号原子序数原子半径/nm结论第一周期10.037同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)第二周期3→90.152→0.071大→小第三周期11→170.186→0.099大→小规律:同周期中,随着原子序数的递增,元素的原子半径呈现周期性变化3.元素的主要化合价周期序号原子序数主要化合价结论第一周期1→2+1→0①同周期由左向右,元素的最高正价逐渐升高(+1→+7,O和F无最高正价);②元素的最低负价由第ⅣA族的-4价逐渐升高至第ⅦA族的-1价;③最高正价+|最低负价|=8第二周期3→9最高价+1→+5(不含O、F)最低价-4→-1第三周期11→17最高价+1→+7最低价-4→-1规律:同周期中,随着原子序数的递增,元素的主要化合价呈现周期性变化思考与交流:电子层数多的元素原子半径一定大于电子层数少的元素吗?【答案】(1)同周期元素电子层数相同,从左到右,核电荷数依次增多,即原子核所带正电荷增多,原子核对核外电子吸引力增大,原子半径逐渐减小。(2)不一定,如第二周期的Li元素比第三周期的S、Cl等元素原子的半径大,应综合分析电子层数和核电荷数的影响。【归纳总结】1.主族元素主要化合价的确定方法(1)最高正价=主族的序号=最外层电子数(O、F除外)。(2)最低负价=最高正价-8(H、O、F除外)。(3)H最高价为+1,最低价为-1;O无最高正价;F无正化合价。2.最简单氢化物及其最高价氧化物对应的水化物小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comⅣAⅤAⅥAⅦA氢化物RH4RH3H2RHR最高价氧化物对应的水化物H2RO3或H4RO4H3RO4或HRO3H2RO4HRO4二、同周期元素金属性和非金属性的递变规律以第三周期元素为例探究元素性质的递变规律。1.预测元素性质的递变规律第三周期元素电子层数相同,由左向右核电荷数依次增多,原子半径依次减小,失电子的能力依次减弱,得电子的能力依次增强,预测它们的金属性依次减弱,非金属性依次增强。2.实验探究:金属性的递变规律(1)Na、Mg元素金属性强弱比较原理金属与水反应置换出H2的难易程度操作现象镁条表面附着少量气泡剧烈反应,溶液变成浅红色化学反应-Mg+2H2O=====Mg(OH)2+H2↑结论结合Na与水的反应的现象,Na与水反应置换H2比Mg容易,则金属性:Na>Mg(2)Mg、Al元素金属性强弱比较原理金属的最高价氧化物对应水化物的碱性强弱物质Al(OH)3Mg(OH)2操作现象A中沉淀溶解B中沉淀溶解C中沉淀溶解D中沉淀不溶解A、B、C、D试管中的离子方程式A:Al(OH)3+3H+===Al3++3H2OB:Al(OH)3+OH-===AlO+2H2OC:Mg(OH)2+2H+===Mg2++2H2OD:不反应结论Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:Na>Mg>Al结论:金属性递变规律3.非金属性的递变规律SiPSCl小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com最高价氧化物对应水化物的酸性H2SiO3弱酸H3PO4中强酸H2SO4强酸HClO4强酸酸性:HClO4>H2SO4>H3PO4>H2SiO3结论同周期中,从左到右,元...