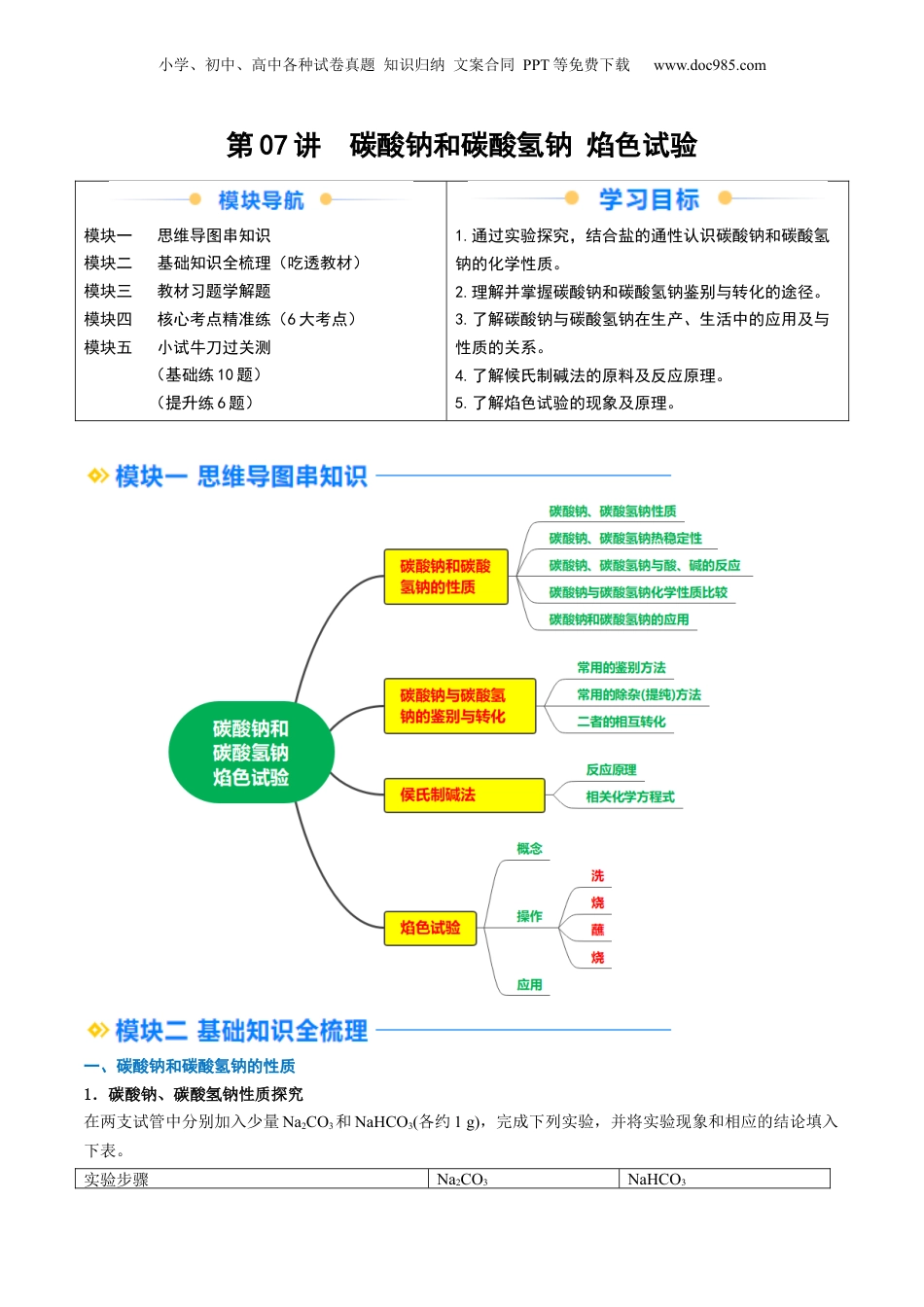
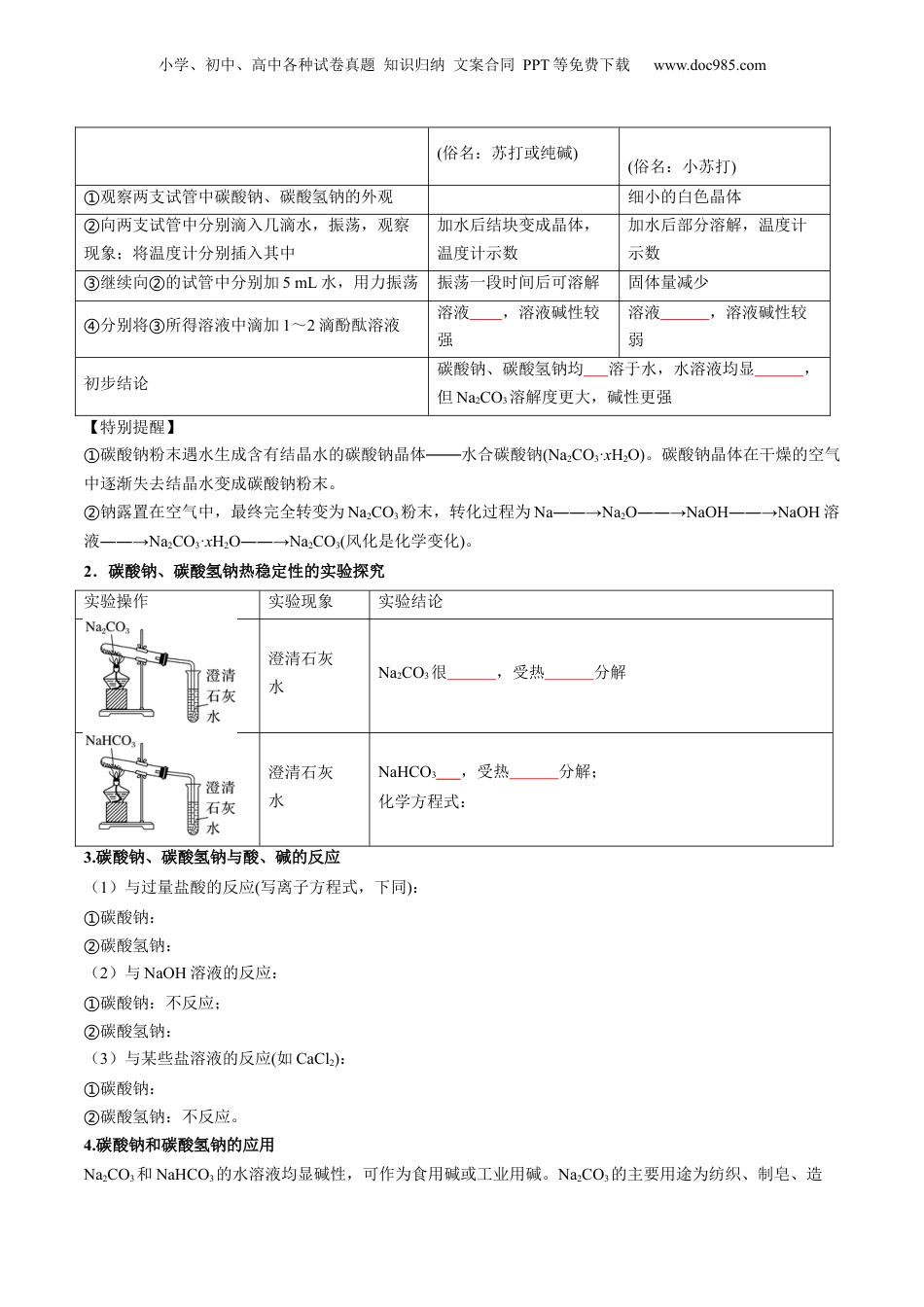
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第07讲碳酸钠和碳酸氢钠焰色试验模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(6大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.通过实验探究,结合盐的通性认识碳酸钠和碳酸氢钠的化学性质。2.理解并掌握碳酸钠和碳酸氢钠鉴别与转化的途径。3.了解碳酸钠与碳酸氢钠在生产、生活中的应用及与性质的关系。4.了解候氏制碱法的原料及反应原理。5.了解焰色试验的现象及原理。一、碳酸钠和碳酸氢钠的性质1.碳酸钠、碳酸氢钠性质探究在两支试管中分别加入少量Na2CO3和NaHCO3(各约1g),完成下列实验,并将实验现象和相应的结论填入下表。实验步骤Na2CO3NaHCO3小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(俗名:苏打或纯碱)(俗名:小苏打)观察两支试管中碳酸钠、碳酸氢钠的外观①细小的白色晶体向两支试管中分别滴入几滴水,振荡,观察②现象;将温度计分别插入其中加水后结块变成晶体,温度计示数加水后部分溶解,温度计示数继续向的试管中分别加③②5mL水,用力振荡振荡一段时间后可溶解固体量减少分别将所得溶液中滴加④③1~2滴酚酞溶液溶液,溶液碱性较强溶液,溶液碱性较弱初步结论碳酸钠、碳酸氢钠均溶于水,水溶液均显,但Na2CO3溶解度更大,碱性更强【特别提醒】碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体水合碳酸钠①——(Na2CO3·xH2O)。碳酸钠晶体在干燥的空气中逐渐失去结晶水变成碳酸钠粉末。钠露置在空气中,最终完全转变为②Na2CO3粉末,转化过程为Na――→Na2O――→NaOH――→NaOH溶液――→Na2CO3·xH2O――→Na2CO3(风化是化学变化)。2.碳酸钠、碳酸氢钠热稳定性的实验探究实验操作实验现象实验结论澄清石灰水Na2CO3很,受热分解澄清石灰水NaHCO3,受热分解;化学方程式:3.碳酸钠、碳酸氢钠与酸、碱的反应(1)与过量盐酸的反应(写离子方程式,下同):碳酸钠:①碳酸氢钠:②(2)与NaOH溶液的反应:碳酸钠:不反应;①碳酸氢钠:②(3)与某些盐溶液的反应(如CaCl2):碳酸钠:①碳酸氢钠:不反应。②4.碳酸钠和碳酸氢钠的应用Na2CO3和NaHCO3的水溶液均显碱性,可作为食用碱或工业用碱。Na2CO3的主要用途为纺织、制皂、造小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com纸、制玻璃等;NaHCO3的主要用途为制药、焙制糕点等。5.碳酸钠与碳酸氢钠化学性质比较碳酸钠碳酸氢钠与盐酸放出气体放出气体(剧烈)与烧碱溶液不反应生成碳酸钠和水与澄清石灰水产生沉淀产生沉淀与氯化钙溶液生成沉淀不反应与CO2生成NaHCO3不反应热稳定性稳定、受热分解不稳定、受热分解相互转化二、碳酸钠与碳酸氢钠的鉴别与转化1.常用的鉴别方法2.常用的除杂(提纯)方法混合物(括号内为杂质)除杂方法或试剂Na2CO3固体(NaHCO3)NaHCO3溶液(Na2CO3)Na2CO3溶液(NaHCO3)3.Na2CO3与NaHCO3的相互转化Na①2CO3+CO2+H2O===2NaHCO32NaHCO②3=====Na2CO3+CO2↑+H2ONaHCO③3+NaOH===Na2CO3+H2O三、侯氏制碱法原料NH3、CO2、饱和食盐水原理往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),利用NaHCO3的溶解性小于NH4HCO3的溶解性原理,使NaHCO3从溶液中析出。NH3+CO2+H2O=NH4HCO3、NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl总反应为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2NaHCO3====Na2CO3+H2O+CO2↑四、焰色试验1.概念很多在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。2.操作3.几种金属元素的焰色金属元素锂钠钾铷钙锶钡铜焰色【特别提醒】铂丝不能用稀硫酸洗涤。①蓝色钴玻璃可以滤去黄光,便于对钾元素焰色的观察。②思考与交流:能用玻璃棒或铜丝来蘸取待测液吗?4.应用(1)检验的存在,如鉴别NaCl和KCl溶液。(2)制作五彩缤纷的烟花。教材习题01将NaHCO3置于干燥的试管中加热,并使放出的气体依次通过盛有足量...