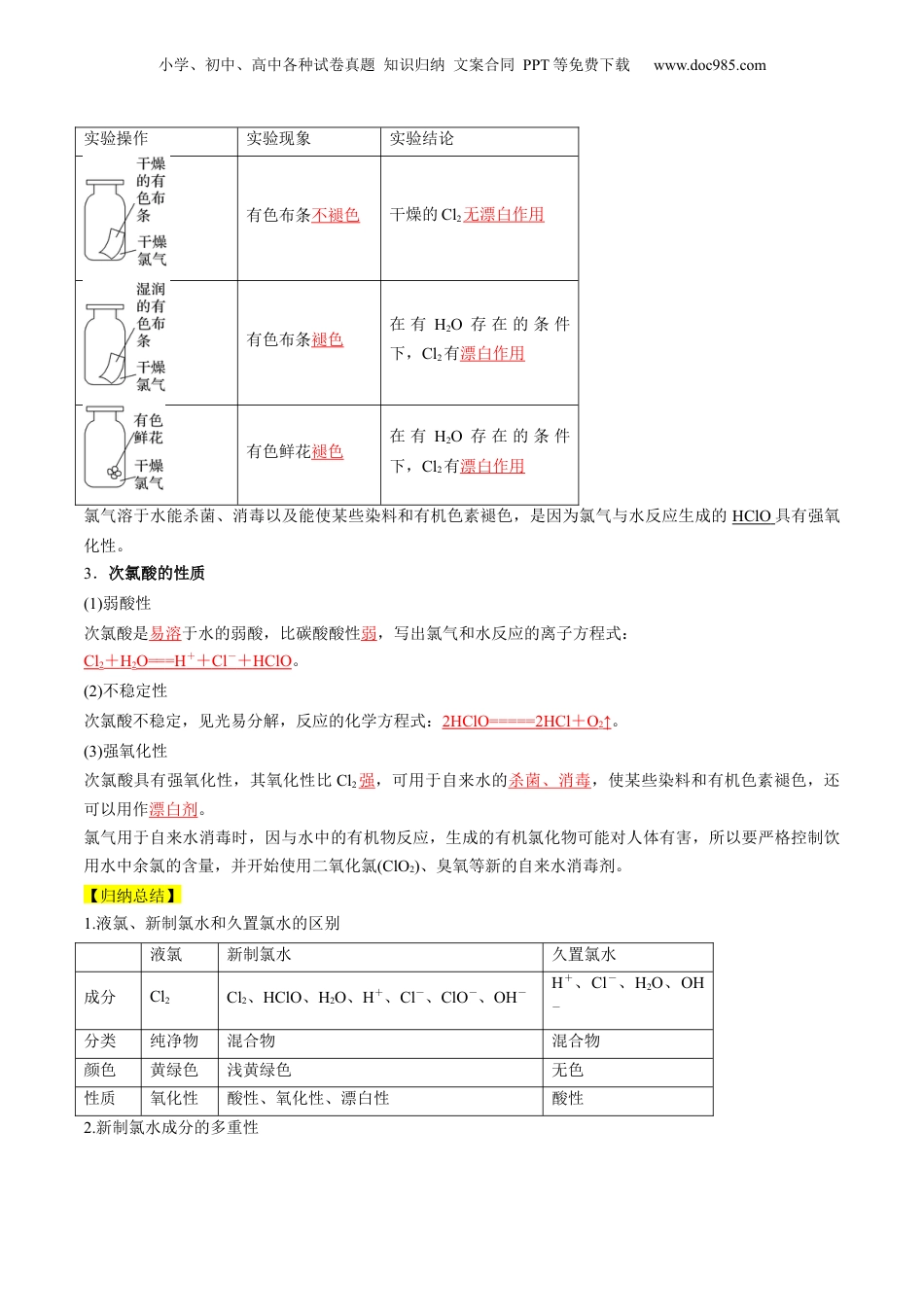
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第08讲氯气的性质和次氯酸模块一思维导图串知识模块二基础知识全梳理(吃透教材)模块三教材习题学解题模块四核心考点精准练(6大考点)模块五小试牛刀过关测(基础练10题)(提升练6题)1.能从原子结构的角度认识氯元素是一种很活泼的非金属元素,其单质具有强氧化性。2.通过实验探究氯气的化学性质,掌握氯气与金属单质、非金属单质及水的反应。3.掌握氯水的成分、次氯酸的性质。4.熟知氯气与碱的反应,漂白粉的主要成分、漂白原理及保存方法。一、氯的存在、氯气的物理性质1.氯的存在氯元素在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com2.氯气的物理性质颜色状态气味毒性溶解性密度黄绿色气体刺激性气味有毒1体积的水可溶解约2体积的氯气比空气大3.液氯氯气的熔、沸点低,在低温和加压条件下可以转化为液态,称为液氯。二、氯气与金属、非金属单质的反应1.原子结构氯原子结构示意图为,容易得到1个电子,氯气的化学性质活泼,常表现强氧化性。2.与金属单质的反应化学方程式反应现象与钠反应2Na+Cl2=====2NaCl产生大量白色烟与铁反应2Fe+3Cl2=====2FeCl3产生大量棕褐色烟与铜反应Cu+Cl2=====CuCl2产生大量棕黄色烟氯气在加热条件下能与大多数金属化合,生成高价金属氯化物。3.与非金属单质(如H2)的反应(1)实验操作:在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中。(2)实验现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。(3)化学方程式:H2+Cl2=====2HCl。【特别提醒】因为HCl极易溶于水,HCl与空气中的水蒸气形成盐酸小液滴。【归纳总结】(1)氯气是很活泼的非金属单质,具有强氧化性。氯气能与绝大多数金属反应,一般把变价金属①(如Fe、Cu)氧化到最高价。氯气在一定条件下能与非金属单质②(如H2、S、P等)反应。(2)燃烧是发光发热的剧烈的化学反应,也是氧化还原反应,不一定要有氧气参与,如2P+3Cl2=====2PCl3等。(3)描述现象时,固体小颗粒分散在空气中形成烟,液体小液滴分散到空气中形成雾。“”“”三、氯气与水的反应1.常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应的化学方程式是Cl2+H2O===HCl+HClO。2.漂白原理的探究实验小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com实验操作实验现象实验结论有色布条不褪色干燥的Cl2无漂白作用有色布条褪色在有H2O存在的条件下,Cl2有漂白作用有色鲜花褪色在有H2O存在的条件下,Cl2有漂白作用氯气溶于水能杀菌、消毒以及能使某些染料和有机色素褪色,是因为氯气与水反应生成的HClO具有强氧化性。3.次氯酸的性质(1)弱酸性次氯酸是易溶于水的弱酸,比碳酸酸性弱,写出氯气和水反应的离子方程式:Cl2+H2O===H++Cl-+HClO。(2)不稳定性次氯酸不稳定,见光易分解,反应的化学方程式:2HClO=====2HCl+O2↑。(3)强氧化性次氯酸具有强氧化性,其氧化性比Cl2强,可用于自来水的杀菌、消毒,使某些染料和有机色素褪色,还可以用作漂白剂。氯气用于自来水消毒时,因与水中的有机物反应,生成的有机氯化物可能对人体有害,所以要严格控制饮用水中余氯的含量,并开始使用二氧化氯(ClO2)、臭氧等新的自来水消毒剂。【归纳总结】1.液氯、新制氯水和久置氯水的区别液氯新制氯水久置氯水成分Cl2Cl2、HClO、H2O、H+、Cl-、ClO-、OH-H+、Cl-、H2O、OH-分类纯净物混合物混合物颜色黄绿色浅黄绿色无色性质氧化性酸性、氧化性、漂白性酸性2.新制氯水成分的多重性小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com四、氯气与碱的反应1.漂白液(1)反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O。(2)漂白液的有效成分是次氯酸钠。2.漂白粉(1)反应的化学方程式:2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。(2)漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2,漂粉精的主要成分是Ca(ClO)2。(3)漂白粉的漂白...